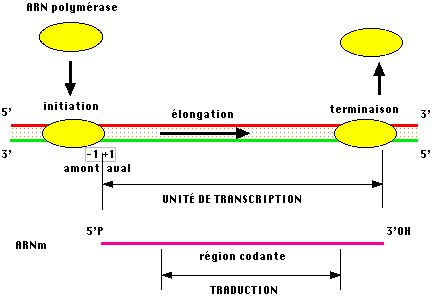
La transcription commence donc en un point précis de l'ADN pour se terminer en un point également précis, l'espace entre les deux constitue une unité de transcription, notion proche du cistron mais pas tout à fait identique.
FLUX
D'INFORMATION GENETIQUE
2 MECANISME GENERAL DE LA
TRANSCRIPTION
La transcription est une biosynthèse d'ARN qui repose, comme celle de l'ADN sur la complémentarité des bases.
Ce processus présente des analogies avec celui de la réplication (chapitre III) mais également des différences
fondamentales:

Il existe des différences sensibles entre la transcription chez les procaryotes et celle des eucaryotes et des différences encore plus importantes dans son contrôle, c'est pourquoi leur étude sera séparée.
2.1 TRANSCRIPTION CHEZ LES PROCARYOTES
L'ARN polymérase d'E. coli est une enzyme assez complexe composée de
quatre sous unités : deux a, une ß, une ß ' et d'autres
éléments protéiques établissent des liaisons temporaires avec ce complexe. Cette
enzyme réalise la polymérisation de ribonucléotides face à un brin d'ADN mais,
in vitro, commence n'importe où et s'arrète n'importe où.
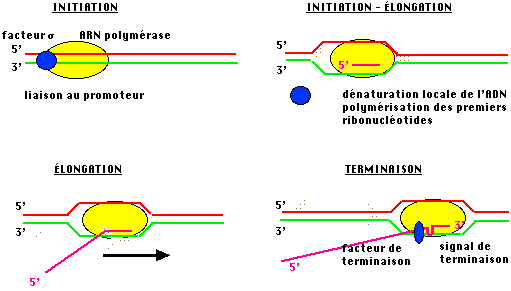
Une protéine
pariculière, le facteur sigma, est capable, in
vivo d'assurer la reconnaissance de séquences spécifiques situées légèrement
en amont du point d'initiation de la transcription : les promoteurs. L'installation de l'ARN polymérase au niveau
précis de ces promoteurs (grâce au facteur s) va
permettre la transcription du bon brin en commençant par le bon nucléotide.
C'est le point crucial de l'initiation.
Au démarrage de l'élongation, le facteur s quitte le complexe.
Cette étape marque le passage à l'allongement de la chaîne d'ARN de 5' vers 3' jusqu'au site de terminaison.
On voit que la transcription correcte, dans l'espace, d'une molécule d'ARN, représentative d'une unité d'information, repose sur le point de départ et sur le point de terminaison.
Comment ces nucléotides précis sont ils déterminés ?
Ce sont les séquences promotrices et les sites de terminaison qui contiennent les informations nécessaires.
Plus d'une centaine de promoteurs d'E.coli ont été séquençés et l'alignement des séquences par rapport au point de départ de la transcription fait ressortir ce que l'on appelle des séquences consensus c'est à dire qui se retrouvent très fréquemment, au même endroit dans les différents promoteurs.
 Une
première , en position -10 est appelée "cassette" -10 ou cassette TATA en raison de sa composition ; une autre est
une cassette -35 dont le consensus est TTGACA. Toute
mutation dans ces régions affecte l'initiation de la transcription, soit dans le
choix du brin à transcrire soit dans la position du point de départ.
Une
première , en position -10 est appelée "cassette" -10 ou cassette TATA en raison de sa composition ; une autre est
une cassette -35 dont le consensus est TTGACA. Toute
mutation dans ces régions affecte l'initiation de la transcription, soit dans le
choix du brin à transcrire soit dans la position du point de départ.
Des
délétions qui modifient les distances de ces séquences, entre elles ou par
rapport au point de départ affectent également la transcription.
Le promoteur est donc défini par des séquences consensus en positions précises.
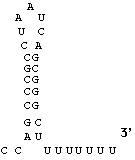 La
terminaison semble pouvoir se faire selon au moins deux mécanismes selon les
renseignements apportés par des expériences de transcription in vitro.
Pour certains cistrons, elle dépend de la structure secondaire prise par l'ARN
lui-même, la séquence de l'extrémité 3' de nombreux messagers bactériens se
rapproche de celle présentée ci contre, le signal de terminaison est ici reconnu
après avoir été transcrit, la séquence polyuridilique en 3' implique une série
de paires A-U (à deux liaisons hydrogène seulement) qui facilite la libération
de la molécule d'ARN.
La
terminaison semble pouvoir se faire selon au moins deux mécanismes selon les
renseignements apportés par des expériences de transcription in vitro.
Pour certains cistrons, elle dépend de la structure secondaire prise par l'ARN
lui-même, la séquence de l'extrémité 3' de nombreux messagers bactériens se
rapproche de celle présentée ci contre, le signal de terminaison est ici reconnu
après avoir été transcrit, la séquence polyuridilique en 3' implique une série
de paires A-U (à deux liaisons hydrogène seulement) qui facilite la libération
de la molécule d'ARN.
Dans d'autres cas, un facteur protéique spécifique, le
facteur rho, est nécessaire pour la terminaison et la libération de la molécule
d'ARN.
*Remarque : Les trois classes d'ARN : ARN ribosomiques, ARN de transfert et ARN messagers sont synthétisés selon ce mécanisme de transcription. Il faut noter que, sur le plan qualitatif, les cistrons ribosomiques et de transfert sont peu diversifiés et occupent une petite partie du génome bien que sur le plan quantitatif, leurs produits puissent représenter plus de 90% de l'ARN cellulaire alors que l'ARN messager, peu représenté dans le cytoplasme peut l'être à partir de cistrons très variés qui se répartissent sur une grande partie du génome. Ce paradoxe est accentué dans la cellule eucaryotique.
2.2 LA TRANSCRIPTION CHEZ LES EUCARYOTES
Le principe est bien entendu le même : il s'agit de transcrire un code d'un système à quatre bases à un autre mais les modalités diffèrent.
2.2.1 LES ARN POLYMERASES
Alors qu'une seule enzyme synthétise toutes les catégories d'ARN des procaryotes, dans la cellule eucaryotique, trois ARN polymérases sont mises en jeu dans la transcription d'ensembles de cistrons différents.
L'ARN polymérase A transcrit les cistrons ribosomiques, elle assure la synthèse des ARN des ribosomes. Son lieu d'action est le nucléole, en effet, les très nombreux cistrons ribosomiques répétés (c'est une de leur caractéristique), sont groupés au niveau de loci précis : les organisateurs nucléolaires. A l'interphase, la transcription active de ces cistrons se manifeste sous forme de structures cytologiques : les nucléoles.
L'ARN polymérase B réalise la synthèse de tous les ARN messagers nucléaires, qui seront traduits en protéines.
L'ARN polymérase C assure la synthèse des petits ARN nucléaires (ARN de transfert et ARN ribosomique 5S) et la transcription de gènes cytoplasmiques (contenus dans les mitochondries et les plastes des végétaux).
Toutes ces polymérases sont des édifices protéiques complexes composés de quatre sous unités, rappelant celles des procaryotes, auxquelles s'ajoutent jusqu'à une douzaine de protomères. De plus, ces complexes ne fonctionnent, in vivo que gràce à l'interaction de nombreux autres facteurs protéiques étabissant des relations temporaires avec le noyau enzymatique.
Ce que l'on connait de la transcription des cistrons ribosomiques rappelle la
transcription de l'ADN procaryotique et nous ne nous y attarderons
pas.
*Remarque : Le mécanisme de transcription "ressemble" ne veut pas dire
que les systèmes de régulation soient identiques.
2.2.3 TRANSCRIPTION DES CISTRONS EXPRIMES EN PROTEINES
La transcription de ces cistrons est assurée par la polymérase B mais, parmi eux, il faut distinguer plusieurs types d'organisation.
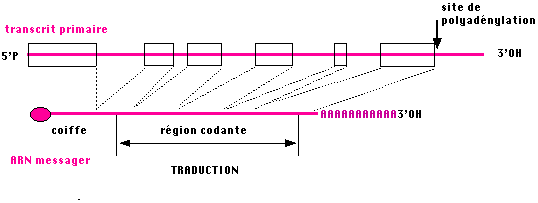
Quelques rares gènes présentent des unités de transcription semblables à celles des procaryotes, le plus souvent, les gènes sont structurés en mosaique de portion codantes (les exons) et de portions n'ayant pas de signification protéique (les introns). L'organisation générale d'un messager eucaryotique est présentée ci-dessous.
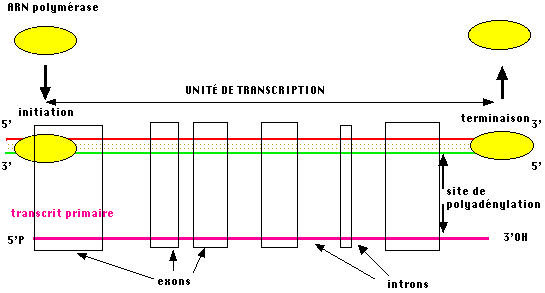
La synthèse
d'ARN chez les eucarotes donne généralement naissance à un produit de
transcription "primaire" (ou prémessager) qui devra subir une maturation pour fournir le messager cytoplasmique
fonctionnel.
Nous allons donc distinguer les deux étapes dans la réalisation
d'un ARN messager fonctionnel : transcription et maturation.
2.2.3.1 TRANSCRIPTION.
Elle est assurée par la polymérase B mais l'initiation (en particulier) fait intervenir d'autres facteurs protéiques du groupe des TF II.
* Remarque : Les ARN polymérases A, B et C avaient été initialement baptisées I, II et III en raison de leur ordre d'élution de certains supports chromatographiques, TF II signifie "Transcription Factor" nécessaire au fonctionnement de la polymérase II (ou B).
La formation du complexe d'initiation nécessaire à la fixation précise de
l'ARN polymérase B est résumée dans la figure ci-dessous.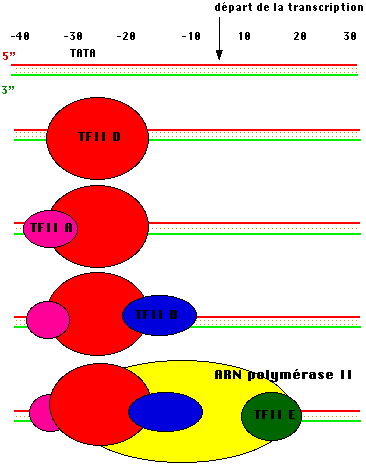
Un premier complexe, TFII-D reconnait le
promoteur et permet la fixation de TFII-A puis des interactions protéiques entre
cet assemblage, TFII-B et la polymérase B permettent la fixation de celle-ci,
son maintien est assuré par TFI-EI . D'autres facteurs (TFII-H et J) participent
à la modification de la topologie de l'ADN .
C'est au
prix de cette complexité que la transcription est correctement initiée
!
Ici encore, tout
repose sur l'interaction de protéines spécifiques avec des séquences
déterminées. Les promoteurs des eucaryotes, reconnus par l'ARN polymérase B (ou
II), ont été étudiés à l'aide des outils les plus performants de la génétique
moléculaire.
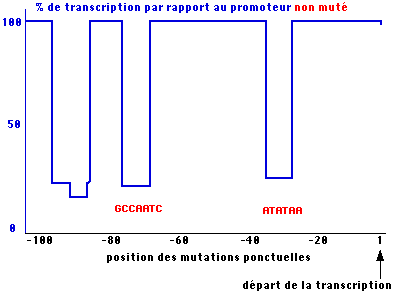 On
note l'effet de mutations introduites à presque chaque position sur les 100
paires de bases en amont du point de début de transcription sur l'efficacité de
l'initiation in vitro. La figure suivante montre que la plupart des
modifications introduites artificiellement n'affectent pas la reconnaissance du
promoteur, seuls, dans l'exemple choisi (promoteur du gène de la globine), trois
modules très restreints aux environs de -30, -75 et
-90 sont indispensables. Des expériences du même genre mais en introduisant des
délétions entre ces modules ont montré que, pour un gène donné, leur position
joue également un rôle.
On
note l'effet de mutations introduites à presque chaque position sur les 100
paires de bases en amont du point de début de transcription sur l'efficacité de
l'initiation in vitro. La figure suivante montre que la plupart des
modifications introduites artificiellement n'affectent pas la reconnaissance du
promoteur, seuls, dans l'exemple choisi (promoteur du gène de la globine), trois
modules très restreints aux environs de -30, -75 et
-90 sont indispensables. Des expériences du même genre mais en introduisant des
délétions entre ces modules ont montré que, pour un gène donné, leur position
joue également un rôle.
Le terme de modules prend toute sa signification
quant on sait que les différents promoteurs en contiennent des assortiments
variés (certains en plusieurs exemplaires et certains en orientation inverse).
- La cassette TATA vers -30 est probablement la seule séquence consensus située à une position fixe présente dans la quasi totalité des gènes de la classe II, elle semble jouer un rôle dans la précision du premier nucléotide transcrit.
- La cassette CAAT est située à -80 dans l'exemple donné du gène de la globine mais sa position peut varier selon les gènes. - La cassette GC (en raison de sa composition en bases) est souvent en plusieurs copies et dans les deux orientations.
Ces modules de base représentent donc un signal pour le complexe d'initiation
de la polymérase B mais leur assemblage en différentes combinaisons possibles
permet déjà une diversification qui va intervenir dans la régulation de la
transcription.
Dans un chapitre suivant, on verra que d'autres modules,
parfois très éloignés du promoteur "de base", jouent également un rôle dans la
régulation.
Bien entendu, l'étape d'initiation de la transcription est cruciale, mais il existe également des éléments nécessaires à l'élongation et à la terminaison qui peuvent jouer un rôle dans le contrôle de la synthèse d'ARN mesagers.
*Remarque : Les signaux de terminaison sont moins bien connus que chez les procaryotes, par contre on connait des signaux de polyadénylation (l'ajout d'une séquence polyadénylée en 3' OH des messagers eucaryotiques fait partie de la maturation).
2.2.3.2 MATURATION
La maturation de la plupart des transcrits primaires porte sur 3 points :
La coiffe est formée par addition d'une guanosine triphosphate : le
premier nucléotide du messager est généralement une purine, A ou G et représente
théoriquement l'extrémité 5' triphosphorylée de la molécule :
5'pppA-pN-pN-pN-pN-pN ... ,
en fait, une guanine est ajoutée par une liaison inhabituelle 5'-5' :
Gppp + pppA-pN-pN-pN-pN-pN >> Gp-ppA-pN-pN-pN-pN-pN...
diverses methylations peuvent se produire ensuite notamment une en position 7 de la guanine et sur le ribose pour compléter cette structure que l'on retrouve dans tous les messagers eucaryotiques.
La polyadénylation est un ajout post-transcriptionnel de nucléotides adényliques au niveau
d'un site de polyadénylation du transcrit primaire. Le site est reconnu par un
complexe protéique comportant une poly-A polymérase.
Cette structure va
former l'extrémité 3' du messager, elle peut aller jusqu'à 2OO nucléotides .
5' 5' 3'
Gp-pA-pN...................pNpA-pA-pA-pA-pA-pA-pA-pA-pA
Les gènes mosaïques sont transcrits depuis le point d'initiation
jusqu'au signal de terminaison, les introns de ce prémessager ou transcrit
primaire doivent donc être éliminés et la jonction des exons se faire avec
précision. L'ensemble se fait simultanément par un mécanisme
d'"épissage".
*Remarque : ce que nous savons du code génétique et du cadre de
lecture permet de comprendre à quel point l'épissage doit être précis, la
jonction exon - intron ne coincidant d'ailleurs pas forcément à une limite entre
deux triplets.
Selon les unités de transcription envisagées, il existe plusieurs mécanismes
d'épissage, tous font intervenir d'autres molécules d'ARN que le transcrit
primaire, dans certains cas, l'ARN lui-même suffit à catalyser la réaction
.
* Remarque : La découverte d'une activité catalytique liée à un acide nucléique
(les ribozymes) a un impact considérable en génétique évolutive.
Le mécanisme décrit ici est celui utilisé pour la plupart des messagers
nucléaires, il fait appel à des ribonucléoprotéines
dont les deux composantes ont certainement leur importance, mais c'est la
molécule d'ARN qui joue un rôle certainement prépondérant.
L'analyse de
nombreux introns de levure a fait apparaitre trois séquences consensus que l'on
a pu généraliser : la première, GU est appelée consensus gauche car elle
représente l'extrémité 5' de l'intron, de même que la droite (AG) représente la
jonction 3' intron - 5' exon suivant, une autre, UACUAAC chez les messagers de
levure (plus généralement Py N Py Py Pu A Py chez les eucaryotes supérieurs, Py
représente une pyrimidine, N un nucléotide quelconque, Pu une purine, l'adénine
étant remarquablement constante) est située peu avant l'extrémité 3' de l'intron
et appelée séquence de branchement pour les raisons évoquées ci-dessous.
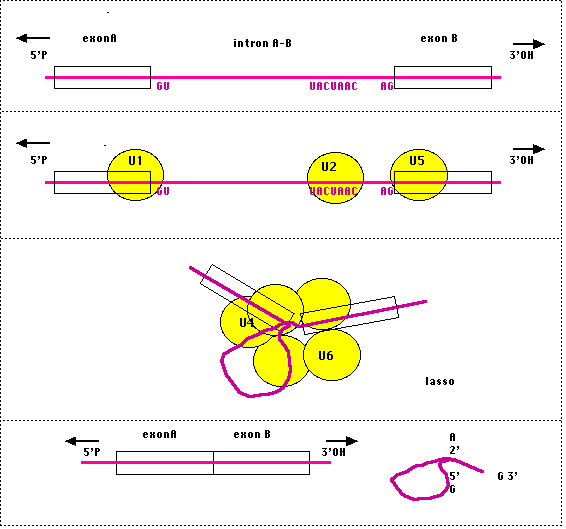 Des
mutations dans les nucléotides codant pour ces trois séquences d'un intron
empèchent l'épissage correct des exons qui l'encadrent.Ces séquences sont
reconnues par des ribonucléoprotéines (en jaune sur le schéma) qui vont former
un complexe nécessaire à l'épissage, appelé splicéosome (de
splicing = épissage), visible en microscopie électronique.
Des
mutations dans les nucléotides codant pour ces trois séquences d'un intron
empèchent l'épissage correct des exons qui l'encadrent.Ces séquences sont
reconnues par des ribonucléoprotéines (en jaune sur le schéma) qui vont former
un complexe nécessaire à l'épissage, appelé splicéosome (de
splicing = épissage), visible en microscopie électronique.
Les
molécules d'ARN de ces complexes, connues depuis longtemps sans qu'on ait pu, au
départ, leur attribuer une fonction, appartiennent au groupe des "petits ARN
nucléaires" : classes discrètes de 100 à 1000 nucléotides, qui ne sortent pas du
noyau, ont un turn-over très lent, sont riches en uridines, et dont chaque
molécule est associée à une dizaine de protéines pour former un complexe parfois
appelé un Snurp (Small Nuclear Uridine-rich
RibonucleoProtein ).
L'édifice représenté sur la figure, imposé par la liaison des différents
Snurps, va replier l'intron et permettre une liaison curieuse de l'extrémité 5'
de l'intron à l'hydroxyle 2' de l'adénine de la séquence consensus dite "de
branchement". L'extrémité 3' va être détachée de la 5' de l'exon suivant et une
liaison phosphodiester peut se créer entre les exons.
*Remarque : Le
branchement en 2' de l'adénosine fait prendre une structure dite en "lasso" à
l'intron, in vivo, ce lasso est immédiatement dégradé mais dans des
expériences in vitro, on peut l'observer en microscopie electronique. Ce
mécanisme complexe est génétiquement controlé et joue un rôle important dans la
régulation de l'expression des gènes chez les eucaryotes.
| relire ? | sommaire cours | sommaire GENET |