Les Biotechnologies industrielles : techniques de base et applications

SOMMAIRE
|
|
| Partie V: Applications de la fermentation | Partie VI: Applications en enzymologie |

SOMMAIRE
|
|
| Partie V: Applications de la fermentation | Partie VI: Applications en enzymologie |
En plus des techniques de base en biologie moléculaire, un certain nombre d'autres bases scientifiques méritent d'être présentées si l'on s'intéresse aux biotechnologies industrielles.
Pour connaître les principales fermentations anaerobies: cliquez ici.
Une animation ![]() qui présente la fermentation alcoolique.
qui présente la fermentation alcoolique.
La fermentation consiste à utiliser des micro-organismes comme moyen de fabrication dans un processus industriel. C'est à dire qu'il faut produire à moindre coût une molécule donnée en quantité et de façon reproductible pour répondre aux besoins du marché.
Pour les raisons qui vont être exposées, la fermentation est une méthode de production relativement onéreuse. Elle ne présente d'intérêt que dans la mesure ou la synthèse chimique à partir de dérivés du pétrole est impossible ou d'un coût plus élevé. La mise en oeuvre de la fermentation dans un objectif industriel doit résoudre à la fois des problèmes biologiques et des problèmes de génie chimique.

Les procédés rencontrés dans la fermentation sont intrinsèquement différents de ceux existants dans l'industrie chimique "classique". Les procédés de la chimie classique ont généralement des rendements très importants, dans des conditions de températures ou de pressions élevées, dans des milieux concentrés sans eaux. Par contre, la fermentation a des rendements modérés (car la bactérie utilise de l'énergie pour vivre), dans des milieux aqueux souvent assez dilués, mais elle se contente de températures et de pressions autour de 1 bar et de 37° C. La principale difficulté est alors d'extraire le produit du milieu et de le purifier. Cette étape influence beaucoup sur les coûts de production.
Pour la production industrielle, il est nécessaire de réaliser des cultures de micro-organismes en très grandes quantités dans des cuves dont le volume peut atteindre plusieurs mètres cubes. Ces installations sont appelées"fermenteur". Les principales difficultés viennent de la nécessité de maintenir des conditions de culture stériles et d'homogénéiser la température et l'aération dans un si grand volume.
Pour obtenir un rendement élevé, il est nécessaire que les cultures soient pures, c’est-a-dire qu’elles ne soient pas contaminées par des organismes étrangers utilisant la matière première et même le produit recherché. L'amélioration des rendements peut aussi être obtenue grâce à des mutants qui accumulent le produit recherché au lieu de le dégrader comme c'est généralement le cas dans la souche sauvage. Enfin, l'étape de purification est simplifié si les micro-organismes excrètent le produit cherché dans le milieu.
La tendance actuelle est une automatisation de plus en plus poussée avec une culture en continue. C'est la technique du"chémostat". Des détecteurs appropriés mesurent continuellement un certain nombre de paramètres biologiques et physico-chimiques de la culture tels que le nombre d'organismes, le pH, l'opacité, la concentration en aliment limitant, celle en produit fabriqué, etc. Ces informations, analysées par un ordinateur, commandent le prélèvement d'une partie de la culture (d'où l'on isolera le produit fabriqué) et l'apport de milieu neuf de façon à maintenir le contenu du fermenteur dans un état optimal.
De tout temps, l'homme a sélectionné empiriquement les populations de micro-organismes qui donnent le meilleur produit (en treme de rendement ou de goût par exemple).
Les choses ont changé récemment avec le concept de "design rationnel". On est capable aujourd'hui de comprendre d'analyser de manière quasi exhaustive les voies métaboliques qui mènent à un substrat comme du sucre à un produit comme le butanol. On est alors capable de comprendre, comme dans une usine, où sont les goulots d'étranglements, où sont les voies sans issue et où sont les fuites qui empêchent une production optimale. Fort de cette connaissance, on peut alors élargir ces goulots, colmater ces fuites et éliminer ces voies sans issue grâce à de l'ingénierie métabolique afin de construire une souche bactérienne optimale pour l'objectif fixé.
Les investissements dans une unité de fermentation se décomposent fondamentalement en deux: d'une part ceux liés à la fermentation et d'autre part ceux liés à la purification. Les premiers vont être influencés parle rendement et la productivité de la bactérie ainsi que par l'optimisation du procédé de fermentation. Les seconds vont être liés à la concentration maximale du produit dans le milieu de culture et au procédé choisi pour extraire le produit du milieu de culture.
Malgré des performances "apparentes" (rendement et concentration) inférieures au procédé classique pétrochimique, les investissements dans un procédé de fermentation sont généralement inférieurs à ceux de la chimie du fait des conditions que doivent supporter les réacteurs dans la pétrochimie (qui impliquent des aciers spéciaux, plus épais, ...). Un deuxième effet vient accentuer ce ticket d'entrée plus faible dans la fermentation, c'est la taille d'efficience. On sait bien que, pour tout procédé, l'augmentation d'échelle permet d'améliorer l'efficacité d'un procédé jusqu'à arriver à une taille minimale efficiente où cela a un sens industriel et économique. Or cette taille est beaucoup plus importante pour la pétrochimie que pour la fermentation ce qui a pour effet d'augmenter la différence pour un nouvel entrant entre un investissement en installation de fermentation et un investissement chimique (qui peut allre jusqu'à un facteur 4).
Comme dans la majorité des produits de chimie de commodité, la part des matières premières dans le coût de production totale représente entre 60 à 70%. On comprend alors l'importance d'avoir accès à des matières premières peu coûteuses. Malgrè les évolutions récentes des prix des matières premières agricoles, celles-ci restent (en terme de "prix carbone") très compétitives par rapport au prix du pétrole et même du charbon. C'est notamment le cas du sucre de canne qui est resté relativement stable par rapport aux autres matières premières. C'est cet effet principal qui permet à la fermentation d'être compétitive vis à vis des procédés chimiques classiques (La jaune et la rouge, février 2009, M. Krel).

Si vous souhaitez un cours complet sur l'enzymologie théorique, consultez le cours de Ph. Collas (UCO Bretagne Nord).
Si vous souhaitez un outil amusant pour faire découvrir les enzymes dans la vie quotidienne par une petite expérience simple à réaliser: Site internet "biologie amusante": des enzymes par milliers.
Pour un industriel, le point de blocage de la production d'une molécule par fermentation, c'est le coût de production par pétrochimie. Les biotechnologies sont une solution envisageable à partir du moment où elles permettent de réduire de plus de 30% le coût de production.
La modélisation informatique joue un rôle essentiel dans l'évaluation à priori des coûts probable de production. 
Voici par exemple le processus conduisant à la création d'une nouvelle production dans la société française METAboli EXplorer. Dans un premier temps, le chemin métabolique optimal et l'objectif de rendement du micro-organisme est défini informatiquement. Puis un autre logiciel guide les biologistes dans le choix des modifications à apporter aux bactéries in vivo pour atteindre le chemin métabolique optimal défini précédemment. Les souches sont évaluées par une approche biochimique classique couplée avec un logiciel de modélisation qui donne une analyse complète des produits synthétisés par la bactérie, à chaque étape de sa modification. Puis les paramètres de fermentation sont optimisés dans une installation pilote afin d'atteindre le meilleur rendement possible à l'échelle industrielle.
Le principe est d'utiliser ce que la nature a crée (biodiversité) pour combiner et produire: par exemple on utilise la séquence consensus de bactéries thermophyles pour faire des enzymes thermo résistantes dans la lessive.
![]() Pour en savoir plus sur les applications en évolution moléculaire et méta-génomique
Pour en savoir plus sur les applications en évolution moléculaire et méta-génomique
La biotechnologie blanche (ou industrielle) utilise les systèmes biologiques pour produire des produits chimiques utiles à travers la biocatalyse
(enzymes) et la fermentation (micro-organismes) à partir de ressources renouvelables et de produits d’origine fossile.
Les applications englobent le secteur des polymères, des carburants, des dissolvants, de la construction (isolation, remblai, couleurs et colles), du papier, du textile, des détergents, dissolvants, laques, colles et produits d'entretien, des produits phytosanitaires, de l'environnement (traitement des déchets), ainsi que de l'industrie agroalimentaire (acides aminés, vitamines, arôme, colorants).

Une animation ![]() pour présenter les grandes lignes de la production d'éthanol à partir de biomasse végétale (anglais).
pour présenter les grandes lignes de la production d'éthanol à partir de biomasse végétale (anglais).
![]() Un article de synthèse présenté par la plate-forme biocarburants.
Un article de synthèse présenté par la plate-forme biocarburants.
Production par fermentation de petites molécules qui entrent dans des chaînes de base de synthèse avec comme objectif d'être moins cher (au moins 30%) que la pétrochimie: exemple des produits fabriqués par METEX (par exemple la L-méthionine) 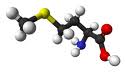


Historiquement, l'un des exemple le plus connu d'utilisation d'enzymes au niveau industriel est la production de la lessive aux enzymes: diaporama power point.
METabolic Explorer (METEX) à clermond ferrand
Il aura fallu le développement de la biochimie et de la biologie moléculaire, puis de l'informatique (modélisation) et maintenant de la méta-génomique pour ouvrir des perspectives nouvelles et passionnantes dans le développement des biotechnologies industrielles.
![]() Pour en savoir plus sur les applications des biotechnologies blanches : Synthèse sur les biotechnologies blanches
Pour en savoir plus sur les applications des biotechnologies blanches : Synthèse sur les biotechnologies blanches

© Université
de TOURS - GÉNET
Document modifié le
21 mai, 2010