REGULATION DE L'EXPRESSION DES
GENES
Comme nous l'avons vu, le programme de transcription n'est pas fixe. La
cellule sait adapter ce programme aux conditions extérieures, au mieux de son
économie ; chez les Eucaryotes, l'environnement peut être représenté par les
cellules voisines, le développement, la différenciation supposent l'expression
régulée de gènes différents dans les diverses cellules. La question qui se pose
maintenant est celle du choix des portions du génome qui doivent être exprimées
à un moment donné dans un environnement donné.
Dans une première partie, nous
allons utiliser l'étude de la cellule procaryotique pour donner quelques
exemples de contrôle de l'expression de gènes et dégager des notions
fondamentales de régulation.
1 - LES
PROCARYOTES
La cellule bactérienne est capable d'adapter très
rapidement son métabolisme aux modifications de l'environnement. Prenons une
suspension de cellules d'Escherichia coli . Une partie de la
suspension est cultivée dans un milieu minimal contenant du lactose
(disaccharide composé de deux molécules de glucose) comme seule source de
carbone (milieu A). Une autre partie est cultivée dans le même milieu minimal
mais contenant du glucose comme source de carbone et auquel on a ajouté les 20
acides aminés (milieu B). On constate que les cellules du milieu A croissent
(prolifèrent), mais moins vite que celles du milieu B. Elles doivent en effet
assurer le clivage du lactose en deux monosaccharides (glucose et galactose)
assimilables et toute la biosynthèse des acides aminés.
L'étude biochimique
et génétique de l'utilisation du lactose par E. coli va nous
montrer comment l'économie réalisée par les cellules cultivées dans le milieu B
(de génotype identique à celcelles cultivées sur le milieu A) se fait, par
adaptation du programme d'expression des gènes, dès le niveau transcriptionnel. Ces résultats sont le fruit des
travaux de Jacob, Monod et leurs collaborateurs dans les années 60.
Par des
méthodes biochimiques appropriées, il est possible de doser l'activité de la
béta-galactosidase (b-galactosidase), enzyme catalysant la dégradation du
lactose. Cette activité est présente dans les cellules du milieu A mais absente
(à la limite de la détection) dans les cellules du milieu B. Si des cellules
"B", sont transférées dans le milieu A (ne contenant plus de glucose mais du
lactose, une activité b-galactosidase apparaît très rapidement et s'amplifie
d'un facteur 1000 en quelques 20 minutes.
L'activité enzymatique est donc
induite par la présence de lactose dans le
milieu.
Inversement, chez ces mêmes cellules transférées dans un milieu
contenant à nouveau du glucose, l'activité enzymatique semble réprimée et
disparaît.
Ainsi, la présence de lactose semble déclencher la synthèse
d'enzymes spécifiques : la b-galactosidase, codée par le gène Lac Z, mais
également une perméase (codée par le gène Lac Y), capable d'accélerer la
pénétration du lactose dans la cellule et une transacétylase codée par le gène
A), qui joue un rôle dans le métabolisme d'autres galactosides. Ces trois
activités enzymatiques sont co-régulées (elles
apparaissent en réponse à une même induction.
Des méthodes très fines de
cartographie montrent que ces gènes sont adjacents dans une région "Lac"
du chromosome bactérien.
* Remarque : L'apparition brutale d'une activité
enzymatique ne suffit pas à prouver une régulation au niveau de la transcription
des gènes. En effet, une enzyme peut être présente sous une forme inactive et
l'induction représenter en fait l'activation de
protéines préexistantes dans le cytoplasme. la preuve directe d'un contrôle au
niveau transcriptionnel a été apportée plus tard grâce aux techniques permettant
de doser des ARN messagers spécifiques. Un ADN complémentaire de l'ARN messager
de la b-galactosidase a été inséré dans un vecteur de clonage. Après
amplification, cette séquence a servi de sonde pour
détecter, dans des préparations brutes d'ARN (extraits avant et après le passage
au lactose), l'ARN messager de la b-galactosidase (seul capable de s'hybrider
avec la sonde) et le quantifier. Les résultats indiquent que l'accumulation de
ce messager débute dès l'induction, elle précède celle de l'enzyme. L'induction porte donc bien sur la transcription du gène
lui-même.
*Remarque : Le lactose fait partie de ce que l'on appelle des molécules effectrices, c'est à dire des molécules capables
de refléter l'environnement cellulaire et de transmettre un signal permettant un
choix transcriptionnel. Il faut noter que, dans cet exemple particulier, le
lactose est loin d'être le meilleur inducteur de la transcription des gènes
impliqués, d'autres petites molécules glycosidiques, naturelles ou artificielles
(telles que l'isopropyl-thiogalactoside ou IPTG) sont beaucoup plus
efficaces et utilisées au laboratoire.
1.1. ANALYSE GENETIQUE DE LA
REGULATION
L'analyse génétique des procaryotes, qui a permis
d'élucider les mécanismes fondamentaux de la régulation, relève d'une gageure :
il s'agit de cellules haploïdes tout au long de leur cycle, sans reproduction
sexuée, nous privant, apparemment des deux outils de base que sont la recombinaison et la complémentation. En fait, dès 1946, Lederberg et Tatum
utilisaient d'une façon très élégante les possibilités de mélange de matériel
génétique chez les bactéries, liées au phénomène de conjugaison.
1.1.1. LA CONJUGAISON
BACTERIENNE
Pour des souches possédant un certain génotype, les
cellules sont capables d'émettre des prolongements cytoplasmiques jusqu'à des
cellules d'un génotype différent et de faire circuler des éléments génétiques
par ce pont. Les éléments génétiques ainsi transférés d'une cellule "donneuse" à une cellule
receveuse (l'échange n'est pas réciproque) sont de nature variée. Le
premier élément identifié a été baptisé facteur F
(comme fertilité).
Il s'agit de l'une des "pièces détachées" du génome
bactérien que sont les petites molécules d'ADN circulaire, extrachromosomiques,
appelées plasmides. Dans le cas du facteur F, il
s'agit en fait d'un épisome qui peut se comporter
soit comme un plasmide soit, par un mécanisme de recombinaison, s'intégrer au
chromosome bactérien. Dans ce dernier cas, son transfert, par conjugaison, peut
entraîner un morceau du chromosome. Ce phénomène (rare) permet la formation de
diploïdes partiels, c'est à dire que la bactérie
receveuse possède des informations génétiques provenant d'une autre cellule. Le
petit fragment de génome ainsi ajouté à l'ensemble résident est appelé exogénote. Sauf s'il possède une origine de réplication et se transmet de façon autonome,
cet élément génétique n'est pas stable et se perd en quelques heures, dans
certains cas, il peut cependant s'intégrer au chromosome de la bactérie
receveuse par recombinaison homologue.
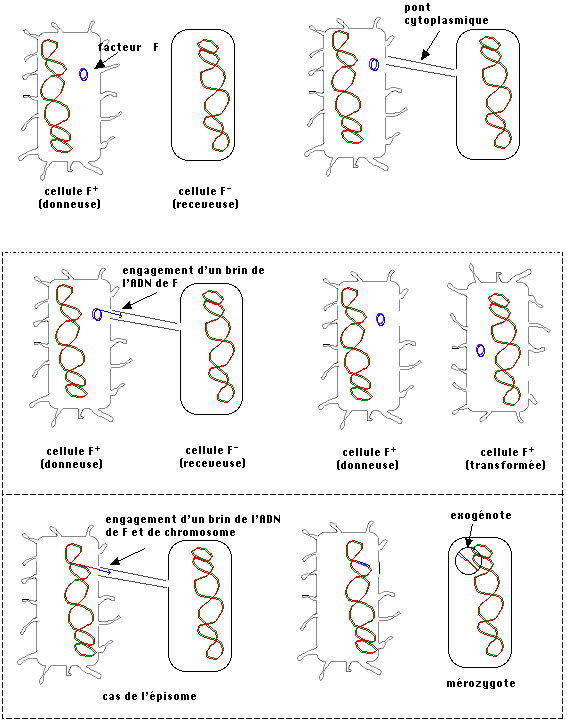
* Remarque :
Pour des raisons mécaniques, le pont cytoplasmique de conjugaison est rapidement
rompu, en aucun cas le transfert d'une copie complète du chromosome de la
cellule donneuse ne peut avoir lieu. D'où le terme de mérozygote parfois utilisé pour désigner le diploïde
partiel. Le mot zygote rappelle qu'il s'agit de sexualité, c'est à dire de mise
en commun d'informations génétiques d'origines différentes mais, chez les
procaryotes, la sexualité n'est pas associée à la reproduction.
Lederberg et
Tatum ont apporté la preuve de ce transfert de gènes entre bactéries en
réalisant l'expérience suivante. Elle consiste à mélanger deux souches porteuses
de mutations différentes. Par exemple une souche A n'est capable de se
développer dans un milieu minimal non supplémenté en
méthionine et en biotine. Elles sont devenues auxotrophes pour ces composés par perte
de fonction de gènes impliqués, l'un dans la biosynthèse de méthionine,
l'autre dans la biosynthèse de la biotine. Ces mutations sont symbolisées par un
génotype met-
bio- . Une autre souche, la souche B, est de
génotype thr-
leu- et thi- ,
ici, trois gènes sont mutés et les cellules ont besoin de l'adjonction de
thréonine, de leucine et de thiamine au milieu minimal pour se développer. Des
bactéries des souches A et B sont mélangées et laissées environ 1 heure dans un
milieu contenant tous les éléments nécessaires à la survie des deux (
méthionine, biotine, thréonine, leucine et thiamine). La suspension est étalée
sur un milieu minimal (non supplémenté) et, après environ 12h, on voit se
développer quelques rares colonies.
Rare excluant malgré tout une possibilité
de réversion de mutation (voir le chapitre concernant la nature du matériel
génétique), il faut conclure qu'un transfert d'allèles sauvages a été possible
d'une cellule à une autre. (exercice)
Deux explications, non exclusives,
permettent de rendre compte du phénotype sauvage : soit l'exogénote, qui
présente une grande homologie avec une région précise du chromosome de la
cellule receveuse, va s'échanger avec cette région par recombinaison, soit il
est transmis à la descendance (parce qu'il possède une origine de réplication
par exemple) et il est capable de complémenter les allèles défectueux des clones
issus de la cellule receveuse. C'est ce dernier cas qui va être utilisé dans
l'étude de la régulation.
* Remarque : La conjugaison représente un moyen
naturel de transfert de matériel génétique. Par la suite, des souches dites
Hfr (comme haute fréquence de recombinaison), dont le
facteur F est toujours intégré dans le chromosome, ont été sélectionnées .
Actuellement, la transformation, par des plasmides recombinés in vitro,
apporte une grande souplesse et une grande efficacité dans la création de
diploïdes partiels. De plus, des souches mutées, incapables de recombinaison
(in vivo) permettent d'étudier, sans ambiguïté, les effets de
complémentation.
1.1.2 EXEMPLE DE L'ADAPTATION A L'UTILISATION DU
LACTOSE
Plusieurs types de mutation peuvent interférer avec
l'utilisation du lactose.
- Des mutations dans le gène Z empêchent le catabolisme du lactose
par absence de b-galactosidase, des mutations dans le gène Y empêchent
la pénétration active du lactose à l'intérieur de la cellule. Dans ces deux
cas le phénotype, symbolisé par lac-, c'est à
dire impossibilité d'utiliser le lactose, résulte d'un défaut enzymatique.
- D'autres mutations perturbent d'une façon tout à fait différente
l'utilisation du lactose : elles affectent la production de trois enzymes en
même temps (b-galactosidase, perméase et transacétylase). Plusieurs de ces
mutations entraînent un phénotype constitutif c'est
à dire production d'enzymes en absence d'inducteur.
Etant donné que les trois gènes cartographient côte à côte sur le chromosome,
on peut supposer que leur expression est régulée par un même
système et que les mutations constitutives affectent non pas une
production d'enzyme mais un élément de contrôle. Cet ensemble forme ce que l'on
appelle un opéron bactérien.
Les premières
mutations constitutives étudiées ont été appelées
I-et sont localisées près du gène Z, par la
suite on a caractérisé des mutants constitutifs Oc,
ces mutations sont situées encore plus près de Z.
L'analyse de ces
mutants par des expériences très élégantes faisant appel à des diploïdes
partiels a permis au groupe de Monod et Jacob d'élaborer le célèbre modèle de régulation de l'opéron lactose par répression de la transcription.
Le tableau ci-dessous
rappelle les caractéristiques phénotypiques des mutants utilisés.
| GENOTYPE |
PHENOTYPE |
| I+ O+ Z+ Y+ |
sauvage (inductible) |
| I+ O+ Z-
Y+
I+ O+ Z+ Y- |
Lac- (non inductible) |
| I- O+ Z+ Y+
I+ Oc Z+ Y+ |
constitutif |
Pour la conjugaison, des souches Hfr (F+), sensibles à
la streptomycine (Sms) sont utilisées comme cellules
donneuses, les souches receveuses sont résistantes à la streptomycine
(Smr). Après contact, les cellules sont étalées sur un milieu
contenant de la streptomycine et contenant ou non un inducteur (ici de l'IPTG).
Le tableau suivant résume les principaux "croisements" réalisés et indique la
production de b-galactosidase en présence ou en absence d'inducteur (+ indique
une production, - son absence).
|
sans
inducteur |
IPTG |
| F+SmsI+O+Z+
/ SmrI+O+Z- |
- |
+ |
| F+SmsI+O+Z+
/ SmrI-O+Z+ |
- |
+ |
| F+SmsI+O+Z+
/ SmrI+OcZ+ |
+ |
+ |
*Remarque : Ce tableau est à analyser avec beaucoup d'attention,
l'interprétation de tels résultats a valu le prix Nobel à F. Jacob, J. Monod et
A. Lwoff.
1.1.3. MODELE DE REGULATION PAR REPRESSION DE LA
TRANSCRIPTION
La présence de b-galactosidase chez un diploïde
partiel Z-/Z+ indique qu'une complémentation est possible,
l'allèle Z+ de la cellule donneuse est exprimé dans le cytoplasme de
la cellule receveuse (on peut dire que l'allèle Z+, sauvage, est
dominant par rapport à Z-, muté).
De même, la présence de
l'allèle I+ rétablit le contrôle normal (inductible) de l'expression du gène Z.
On peut en conclure que ce gène est exprimé en une protéine capable d'agir sur
la transcription de l'opéron. Monod et Jacob proposent que cette protéine
(produit du gène I) soit un répresseur de la transcription lorsque l'inducteur
est absent (l'induction serait en fait une levée de la répression).
Les
résultats obtenus avec les diploïdes partiels O+/Oc sont
très différents, il n'y a pas complémentation, l'allèle muté semble dominant par
rapport au sauvage. Ceci ne peut s'expliquer que si le locus O n'est pas un gène
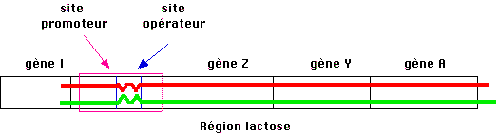
exprimé mais une séquence particulière d'ADN que l'on appellera le site
opérateur. Le schéma de fonctionnement de l'opéron serait alors le suivant : en
absence d'inducteur, le répresseur produit par le gène reconnaît spécifiquement
le site O et s'y fixe. 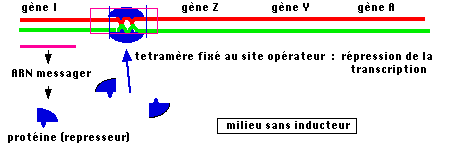 L'encombrement de ce complexe (on découvrira plus tard que
c'est en fait un tétramère qui se fixe) est tel que l'ARN polymérase est
incapable de se fixer au site promoteur. Le promoteur étant unique pour les
trois unités de fonction Z, Y et A, on comprend que la répression bloque la
transcription de l'ensemble.
L'encombrement de ce complexe (on découvrira plus tard que
c'est en fait un tétramère qui se fixe) est tel que l'ARN polymérase est
incapable de se fixer au site promoteur. Le promoteur étant unique pour les
trois unités de fonction Z, Y et A, on comprend que la répression bloque la
transcription de l'ensemble.
Comment se fait l'induction ?
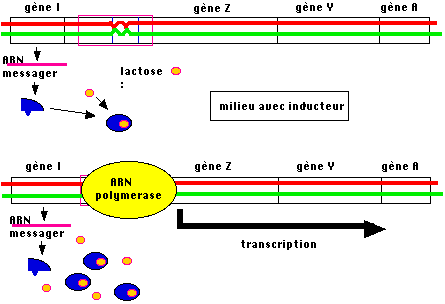 Une propriété très
intéressante de certaines protéines est celle d'allostérie : la fixation d'une molécule particulière
(ligand) peut provoquer une modification globale de la structure
tridimensionnelle d'une protéine réceptrice. C'est ce qui ce produit ici, le
lactose a une affinité pour la protéine répresseur et sa liaison provoque une
transition allostérique de celui-ci. Si l'on tient compte du fait que
l'interaction d'une protéine avec une séquence d'ADN nécessite l'établissement
de liaisons hydrogène entre des atomes précis d'acides aminés précis et des
atomes précis de bases, la déformation de la protéine ne permettra plus cette
interaction et le complexe répresseur-inducteur sera incapable de se fixer à
l'opérateur.
Une propriété très
intéressante de certaines protéines est celle d'allostérie : la fixation d'une molécule particulière
(ligand) peut provoquer une modification globale de la structure
tridimensionnelle d'une protéine réceptrice. C'est ce qui ce produit ici, le
lactose a une affinité pour la protéine répresseur et sa liaison provoque une
transition allostérique de celui-ci. Si l'on tient compte du fait que
l'interaction d'une protéine avec une séquence d'ADN nécessite l'établissement
de liaisons hydrogène entre des atomes précis d'acides aminés précis et des
atomes précis de bases, la déformation de la protéine ne permettra plus cette
interaction et le complexe répresseur-inducteur sera incapable de se fixer à
l'opérateur.
Le principe d'interaction protéine (en tant que séquence spécifique
d'acides aminés conditionnant sa structure tridimensionnelle) et séquence d'ADN
permet de comprendre l'effet des mutations I- et
Oc.
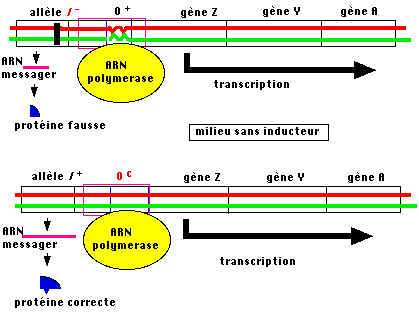 Une mutation dans le locus I conduit à une altération de la structure
du répresseur voire à une absence de la protéine (allèle nul). Dans tous les
cas, une liaison répresseur - opérateur ne peut s'établir et l'ARN polymérase
peut s'installer à l'opérateur. Si le répresseur possède une structure correcte
mais que la séquence opératrice est altérée par une mutation (Oc par exemple),
le résultat est le même : aucune possibilité de former un complexe répresseur -
opérateur ; la transcription de l'opéron est possible en permanence.
Une mutation dans le locus I conduit à une altération de la structure
du répresseur voire à une absence de la protéine (allèle nul). Dans tous les
cas, une liaison répresseur - opérateur ne peut s'établir et l'ARN polymérase
peut s'installer à l'opérateur. Si le répresseur possède une structure correcte
mais que la séquence opératrice est altérée par une mutation (Oc par exemple),
le résultat est le même : aucune possibilité de former un complexe répresseur -
opérateur ; la transcription de l'opéron est possible en permanence.
1.1.4 LE REPRESSEUR
Une confirmation d'un mode
de régulation par répression a été apportée par des mutations Is, s
signifiant "super-réprimé". Ces mutants sont incapables d'utiliser le lactose
car l'opéron est réprimé en permanence, le lactose ne peut induire la
transcription. Les mutations affectent bien le gène I, mais dans une région
importante pour la formation du complexe répresseur - inducteur. La région
essentielle pour la liaison du répresseur à la séquence opératrice étant
intacte, l'état réprimé est stable.
Ces observations permettent d'aborder un
aspect plus général des protéines de régulation, celui de domaines fonctionnels
spécialisés. L'analyse détaillée de la protéine après clonage du gène I dans un
vecteur d'expression et surproduction par des clones bactériens transformés
(voir le chapitre correspondant) confirmera ce concept. Les mutations
I-, Is et d'autres ne sont pas disposées de façon
aléatoire dans le gène mais leur cartographie reflète le fait qu'une partie de
la protéine codée est essentielle dans la reconnaissance du site opérateur, une
autre région est nécessaire pour la fixation de l'inducteur et la transition
allostérique, une autre permet la formation d'un tétramère. Cette notion de
protéines de régulation modulaires, séparables en domaines fonctionnels, se
retrouvera chez les Eucaryotes.
1.1.5. OPERON
INDUCTIBLE ET OPERON "REPRESSIBLE"
L'opéron lactose ne fonctionne
que s'il est induit par une molécule effectrice capable de lever l'effet du
répresseur, il est dit inductible. Dans d'autres cas c'est l'inverse, la
molécule effectrice provoque la répression de la transcription, l'opéron est dit
répressible.
Un exemple typique nous est fourni par un opéron intervenant
dans la biosynthèse du tryptophane.
*Remarque : l'opéron lactose intervient
dans le catabolisme, l'opéron tryptophane intervient dans l'anabolisme.
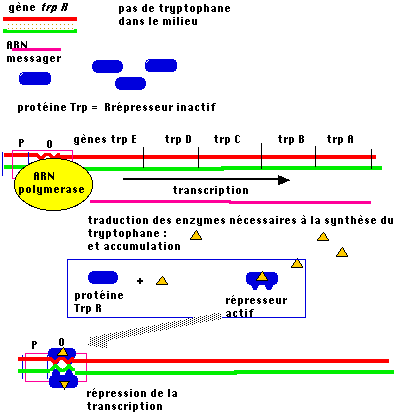 Cet
opéron comporte cinq gènes codant pour des enzymes impliquées dans la synthèse
du tryptophane (les cistrons trpE, D, C, Bet A) groupés, sous la dépendance d'un
seul système promoteur - opérateur. Un gène, trp R, qui ne fait pas partie de
l'opéron, code pour un répresseur spécifique de l'opéron tryptophane. Cette
protéine est incapable de se lier au site opérateur, et par conséquent inactive,
tant qu'elle n'est pas complexée avec une molécule effectrice : le tryptophane
lui-même. Il agit donc comme un corépresseur dans ce mécanisme de régulation en
retour par le produit final de la chaine métabolique de l'opéron.
Cet
opéron comporte cinq gènes codant pour des enzymes impliquées dans la synthèse
du tryptophane (les cistrons trpE, D, C, Bet A) groupés, sous la dépendance d'un
seul système promoteur - opérateur. Un gène, trp R, qui ne fait pas partie de
l'opéron, code pour un répresseur spécifique de l'opéron tryptophane. Cette
protéine est incapable de se lier au site opérateur, et par conséquent inactive,
tant qu'elle n'est pas complexée avec une molécule effectrice : le tryptophane
lui-même. Il agit donc comme un corépresseur dans ce mécanisme de régulation en
retour par le produit final de la chaine métabolique de l'opéron.
1.1.6 CONTROLE NEGATIF ET CONTROLE POSITIF
Les gènes soumis à un contrôle négatif ne sont pas transcrits si
un répresseur est lié à l'opérateur. C'est le cas des opérons lactose ou
tryptophane.
Les gènes soumis à un contrôle positif ne sont transcrits
efficacement que si une protéine régulatrice favorise l'initiation.
L'opéron
lactose est également soumis à un contrôle positif. Il a été précisé au début de
ce chapitre que la transcription est induite si l'on remplace le glucose par du
lactose comme seule source de carbone dans le milieu minimal. En effet, si l'on
ajoute du lactose, l'opéron n'est pas transcrit tant que le glucose n'est pas
épuisé. Ce phénomène, qui concerne de nombreux opérons du catabolisme est appelé
"effet glucose" ou encore "répression catabolique". Il repose, comme les autres
modes de régulation sur une protéine à régulation allostérique et une molécule
effectrice. Deux types de mutations abolissent l'effet glucose : le premier
concerne les gènes impliqués dans la formation de l'adénosine monophosphate
cyclique (AMPc,) notamment celui de l'adénylate cyclase, le second dans un gène
codant pour une protéine appelée "CAP" comme protéine activatrice du
catabolisme.
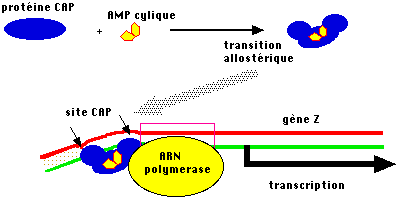 On a pu montrer que le glucose freine la production d'AMP cyclique à
partir de l'ATP et maintient un très faible niveau d'AMPc. Lorsque le glucose
diminue, la concentration en AMPc augmente, or cette molécule peut former un
complexe spécifique avec la protéine CAP. Il en résulte une modification de la
structure tridimensionnelle et le complexe est capable de se fixer sur l'ADN, au
niveau d'une séquence particulière appelée site CAP, située un peu en amont du
promoteur. La liaison entraîne une contrainte topologique de la double hélice
d'ADN qui favorise l'initiation de la transcription.
On a pu montrer que le glucose freine la production d'AMP cyclique à
partir de l'ATP et maintient un très faible niveau d'AMPc. Lorsque le glucose
diminue, la concentration en AMPc augmente, or cette molécule peut former un
complexe spécifique avec la protéine CAP. Il en résulte une modification de la
structure tridimensionnelle et le complexe est capable de se fixer sur l'ADN, au
niveau d'une séquence particulière appelée site CAP, située un peu en amont du
promoteur. La liaison entraîne une contrainte topologique de la double hélice
d'ADN qui favorise l'initiation de la transcription.
1.2 CONCLUSION
Les quelques exemples qui ont été
choisis (il existe d'autres mécanismes qui n'ont pas été décrits ici) montrent
que quel que soit le mode de contrôle, positif ou négatif, quelles qu'en soient
les modalités dans le détail, le schéma de base est le même.
Les gènes
codant pour des enzymes (tels que LacZ, Y, TrpA ...) sont appelés des gènes de structure : leur produit participe directement à
la structure de la cellule ou à son métabolisme (les enzymes, les protéines
membranaires, les protéines des ribosomes etc sont codées par de tels gènes. A
côté de celà, d'autres éléments informatifs interviennent dans le contrôle de
l'expression des gènes de structure.
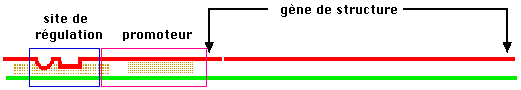
Au niveau
transcriptionnel, on envisage des gènes de régulation
codant pour des protéines sans fonction enzymatique, des protéines de régulation (le répresseur, la protéine CAP en
sont des exemples) qui agissent en trans (sur un site
pouvant être éloigné) en se fixant spécifiquement à une séquence précise d'ADN
que l'on appellera site de régulation, ces sites
assurent une cis-régulation sur l'efficacité du
promoteur situé sur la molécule d'ADN. La relation avec l'environnement intra ou
extra cellulaire est assurée par des molécules effectrices (le lactose, l'AMPc
en sont des exemples). La souplesse de la régulation est liée aux propriétés de
modifications allostériques des protéines de régulation, qui, selon leur
conformation assurent ou n'assurent pas leur fonction.
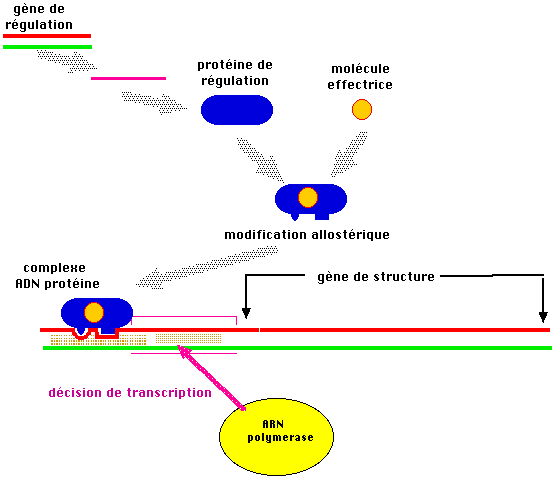
| Si la notion d'opéron est restreinte aux cellules
Procaryotes (chaque cistron eucaryotique possède son propre promoteur), on
verra que ce schéma de base est applicable au contrôle de l'expression des
gènes des Eucaryotes. |


 L'encombrement de ce complexe (on découvrira plus tard que
c'est en fait un tétramère qui se fixe) est tel que l'ARN polymérase est
incapable de se fixer au site promoteur. Le promoteur étant unique pour les
trois unités de fonction Z, Y et A, on comprend que la répression bloque la
transcription de l'ensemble.
L'encombrement de ce complexe (on découvrira plus tard que
c'est en fait un tétramère qui se fixe) est tel que l'ARN polymérase est
incapable de se fixer au site promoteur. Le promoteur étant unique pour les
trois unités de fonction Z, Y et A, on comprend que la répression bloque la
transcription de l'ensemble.
 Une propriété très
intéressante de certaines protéines est celle d'allostérie : la fixation d'une molécule particulière
(ligand) peut provoquer une modification globale de la structure
tridimensionnelle d'une protéine réceptrice. C'est ce qui ce produit ici, le
lactose a une affinité pour la protéine répresseur et sa liaison provoque une
transition allostérique de celui-ci. Si l'on tient compte du fait que
l'interaction d'une protéine avec une séquence d'ADN nécessite l'établissement
de liaisons hydrogène entre des atomes précis d'acides aminés précis et des
atomes précis de bases, la déformation de la protéine ne permettra plus cette
interaction et le complexe répresseur-inducteur sera incapable de se fixer à
l'opérateur.
Une propriété très
intéressante de certaines protéines est celle d'allostérie : la fixation d'une molécule particulière
(ligand) peut provoquer une modification globale de la structure
tridimensionnelle d'une protéine réceptrice. C'est ce qui ce produit ici, le
lactose a une affinité pour la protéine répresseur et sa liaison provoque une
transition allostérique de celui-ci. Si l'on tient compte du fait que
l'interaction d'une protéine avec une séquence d'ADN nécessite l'établissement
de liaisons hydrogène entre des atomes précis d'acides aminés précis et des
atomes précis de bases, la déformation de la protéine ne permettra plus cette
interaction et le complexe répresseur-inducteur sera incapable de se fixer à
l'opérateur.
 Une mutation dans le locus I conduit à une altération de la structure
du répresseur voire à une absence de la protéine (allèle nul). Dans tous les
cas, une liaison répresseur - opérateur ne peut s'établir et l'ARN polymérase
peut s'installer à l'opérateur. Si le répresseur possède une structure correcte
mais que la séquence opératrice est altérée par une mutation (Oc par exemple),
le résultat est le même : aucune possibilité de former un complexe répresseur -
opérateur ; la transcription de l'opéron est possible en permanence.
Une mutation dans le locus I conduit à une altération de la structure
du répresseur voire à une absence de la protéine (allèle nul). Dans tous les
cas, une liaison répresseur - opérateur ne peut s'établir et l'ARN polymérase
peut s'installer à l'opérateur. Si le répresseur possède une structure correcte
mais que la séquence opératrice est altérée par une mutation (Oc par exemple),
le résultat est le même : aucune possibilité de former un complexe répresseur -
opérateur ; la transcription de l'opéron est possible en permanence.
 Cet
opéron comporte cinq gènes codant pour des enzymes impliquées dans la synthèse
du tryptophane (les cistrons trpE, D, C, Bet A) groupés, sous la dépendance d'un
seul système promoteur - opérateur. Un gène, trp R, qui ne fait pas partie de
l'opéron, code pour un répresseur spécifique de l'opéron tryptophane. Cette
protéine est incapable de se lier au site opérateur, et par conséquent inactive,
tant qu'elle n'est pas complexée avec une molécule effectrice : le tryptophane
lui-même. Il agit donc comme un corépresseur dans ce mécanisme de régulation en
retour par le produit final de la chaine métabolique de l'opéron.
Cet
opéron comporte cinq gènes codant pour des enzymes impliquées dans la synthèse
du tryptophane (les cistrons trpE, D, C, Bet A) groupés, sous la dépendance d'un
seul système promoteur - opérateur. Un gène, trp R, qui ne fait pas partie de
l'opéron, code pour un répresseur spécifique de l'opéron tryptophane. Cette
protéine est incapable de se lier au site opérateur, et par conséquent inactive,
tant qu'elle n'est pas complexée avec une molécule effectrice : le tryptophane
lui-même. Il agit donc comme un corépresseur dans ce mécanisme de régulation en
retour par le produit final de la chaine métabolique de l'opéron.
 On a pu montrer que le glucose freine la production d'AMP cyclique à
partir de l'ATP et maintient un très faible niveau d'AMPc. Lorsque le glucose
diminue, la concentration en AMPc augmente, or cette molécule peut former un
complexe spécifique avec la protéine CAP. Il en résulte une modification de la
structure tridimensionnelle et le complexe est capable de se fixer sur l'ADN, au
niveau d'une séquence particulière appelée site CAP, située un peu en amont du
promoteur. La liaison entraîne une contrainte topologique de la double hélice
d'ADN qui favorise l'initiation de la transcription.
On a pu montrer que le glucose freine la production d'AMP cyclique à
partir de l'ATP et maintient un très faible niveau d'AMPc. Lorsque le glucose
diminue, la concentration en AMPc augmente, or cette molécule peut former un
complexe spécifique avec la protéine CAP. Il en résulte une modification de la
structure tridimensionnelle et le complexe est capable de se fixer sur l'ADN, au
niveau d'une séquence particulière appelée site CAP, située un peu en amont du
promoteur. La liaison entraîne une contrainte topologique de la double hélice
d'ADN qui favorise l'initiation de la transcription.

