Biotechnologies et reproduction humaine
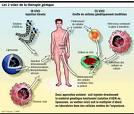

Dans les biotechnologies rouges, nous avons choisi de présenter dans un chapitre à part tout ce qui touche à la reproduction humaine. En effet, les techniques, la législation, le marché et les débats de société que ce domaine peut suciter nous a conduit à le présenter en marge de l'industrie pharmaceutique qui pour sa part ne participe pas ou très peu à ce type d'activité. Concernant la législation française, c'est la Loi n°2004-800 du 6 août 2004 relative à la bioéthique qui est en vigueur actuellement et qui régit l'ensemble des activités dans le domaine de la reproduction humaine.
Le texte ci-dessous est tiré du dossier Cellules souches et clonage: l'humain un cas à part? ©Science & Décision http://www.science-decision.fr
NB: les nombres indiqués entre [] font références à des publications qui peuvent être consultées dans la partie références bibliographiques.
La révision des lois de bioéthique en France et la publicité faite aux résultats des recherches sur les cellules souches et l’embryon humain ont réactualisé certains débats sur la dignité humaine et le « statut de l’embryon ». Savoir quand débute la vie humaine, et par conséquent, à partir de quand il y a lieu de la respecter comme telle, ne relève pas de la biologie. L’objet principal du présent dossier est de dresser un état des lieux des recherches sur les cellules souches (depuis les premiers travaux, il y a plus de soixante ans, jusqu’à aujourd’hui) et d’en cerner les applications prévisibles, notamment en médecine. De façon complémentaire, le cadre réglementaire et législatif est décrit. Etablir si les bénéfices escomptés pour la santé publique légitiment les recherches sur les cellules souches et l’embryon humain sort du cadre de Science & Décision, mais les informations figurant dans ce dossier doivent permettre à chacun de se forger une opinion.
Comment se reproduisent les animaux ?
Le seul mode de reproduction des mammifères et de l’homme dans la nature est la reproduction sexuée : une cellule reproductrice mâle (gamète mâle ou spermatozoïde) féconde une cellule reproductrice femelle (gamète femelle ou ovule ou ovocyte) pour former un oeuf. Celui-ci se divise et prend le nom d’embryon.
L’information génétique (génome) du nouvel individu formé à partir de la fusion des deux gamètes est le résultat du brassage de celle de ses parents.
([32])
Qu’appelle-t-on embryon ? Qu’appelle-t-on foetus ?
Un embryon est un organisme en cours de développement. En règle générale, le terme couvre toutes les étapes, de l’oeuf fécondé à la naissance. Chez l’homme, le terme n’est utilisé que pendant les deux premiers mois de la grossesse. Au-delà, et par simple convention, l’embryon prend le nom de foetus ; il présente à ce moment les grands traits de la morphologie d’un individu à sa naissance.
([31])
 embryon
embryon  foetus
foetus
Quelles sont les grandes étapes du développement de l’embryon humain ?
La fécondation et les premiers stades du développement se déroulent dans la trompe utérine. La fécondation in vitro (FIV) reproduit en laboratoire les deux premiers jours du développement (de la fécondation au stade d’embryon composé de quatre cellules).
L’embryon parvient dans l’utérus après trois ou quatre jours de cheminement dans la trompe utérine. Il s’implante au sixième jour dans la paroi de l’utérus. A ce stade, l’embryon est constitué d’une centaine de cellules de deux types bien distincts : les unes (l’enveloppe externe) produiront le placenta et les autres (la masse cellulaire interne) donneront naissance à toutes les cellules du futur individu.
Le premier organe à apparaître est le coeur, qui se met à battre dès le quatorzième jour. A ce moment, apparaissent également les premières cellules nerveuses ; cependant, l’essentiel du système nerveux central et des organes des sens ne seront réellement en place qu’au cinquième mois. Dans l’état actuel de la médecine, un prématuré peut être maintenu en vie et assisté dans la fin de son développement dès qu’il a atteint vingt semaines.
([23] p. 460, p. 777, p. 897, p. 917, [32], [33])
Comment passe-t-on d’un oeuf à un individu composé de cent mille milliards de cellules ?
Toutes les cellules d’un individu proviennent de la multiplication d’une seule et même cellule : l’oeuf, issu de la fusion d’un ovule et d’un spermatozoïde. Les cellules possèdent toutes le même génome, la même information génétique. A partir de cette information, chaque cellule sait fabriquer les protéines qui lui donnent sa morphologie, ses capacités fonctionnelles. Un être humain est composé de plus de deux cents types cellulaires distincts (cellules du foie, cellules du système nerveux, cellules du muscle, etc.). L’état différencié (spécialisé) de chaque type cellulaire est acquis progressivement au cours du développement embryonnaire. Il implique une succession d’événements qui s’enchaînent dans un ordre déterminé.
L’étude de ces phénomènes complexes est au coeur de la biologie depuis des décennies et n’a pas fini de livrer ses secrets.
([8])
Qu’est-ce que le placenta, à quoi sert-il ?
Le placenta est l’organe qui assure les échanges entre l’embryon et l’utérus de sa mère. Il est le produit des cellules de l’enveloppe externe de l’embryon de cinq à sept jours et de leurs interactions avec l’utérus. Il est relié à l’embryon par le cordon ombilical.
Il est difficile d’imaginer le développement complet d’un embryon in vitro, sans recours à une mère, car on ne sait pas aujourd’hui reproduire les interactions complexes qui se produisent dans le placenta, entre l’embryon et sa mère.
([31])
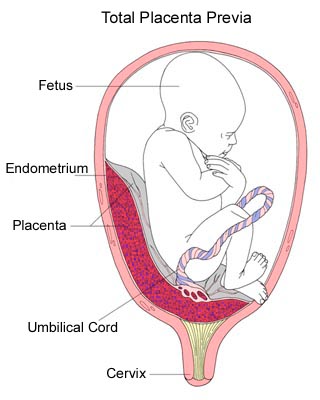 Cliquez sur l'image pour aggrandir
Cliquez sur l'image pour aggrandir
Comment se reproduisent les plantes ?
Les plantes peuvent se reproduire de façon sexuée ou asexuée. L’importance des deux modes de reproduction dans la nature est variable selon les espèces.
Dans la reproduction sexuée, le grain de pollen (gamète male) féconde l’ovule (gamète femelle) pour donner une graine. Le génome de la graine est un mélange des génomes des parents.
La reproduction asexuée prend des formes différentes suivant les espèces. Le bouturage permet de créer, à partir d’un fragment de tige ou de racine, d’une feuille ou d’un bourgeon, une plante semblable à celle dont provient le fragment. Le marcottage consiste à faire émettre des racines à un rameau sans le détacher de la plante mère. Dans tous les cas de reproduction asexuée, la plante fille a le même génome que la plante mère : c’est un clone.
([9])
 Bouturage
Bouturage
Qu’est-ce qu’une cellule ?
La cellule est l’unité élémentaire des êtres vivants. Sa taille est de quelques centièmes de millimètre. Elle comporte un noyau, entouré d’un cytoplasme. Le noyau rassemble la majorité de l’information génétique. Dans le cytoplasme se déroulent la plupart des réactions biochimiques nécessaires à la vie de la cellule (synthèse de molécules et production d’énergie).
Un être humain est composé d’environ cent mille milliards de cellules, appartenant à environ deux cent types différents.
([37])
Qu’est-ce qu’une cellule différenciée ?
Une cellule différenciée est une cellule capable de remplir une mission précise : globule rouge transportant l’oxygène dans le sang, cellules de l’intestin absorbant les nutriments, etc.
Elle se caractérise donc par une fonction physiologique spécifique, une morphologie particulière et la synthèse d’un ensemble de molécules propre à chaque type de différenciation. Il existe environ deux cents types de cellules différenciées chez l’homme. Les cellules différenciées sont organisées en tissus. Chacun d’eux est composé d’un petit nombre de types cellulaires.
Une autre caractéristique de la cellule différenciée est qu’elle ne se divise pas.
([8], [21] Executive summary 2)
 Une cellule nerveuse: le neurone
Une cellule nerveuse: le neurone
Les cellules se renouvellent-elles chez un adulte ?
La majorité des cent mille milliards de cellules d’un adulte ne se divise plus. Cependant, à chaque seconde, plus de vingt millions de cellules de notre organisme se divisent pour maintenir constant le nombre de cellules (remplacement des cellules disparaissant par vieillissement ou par lésion). Le seul maintien du nombre de globules rouges nécessite deux millions de divisions cellulaires par seconde. Ces cellules qui se divisent sont les cellules souches.
([10])
Qu’est-ce qu’une cellule souche ?
Une cellule souche est une cellule qui reste capable de se diviser tout au long de la vie, assurant le renouvellement des cellules d’un individu. La division d’une cellule souche produit une nouvelle cellule souche (cellule de « réserve ») et une cellule s’engageant dans un processus de différenciation qui la conduira à remplir une fonction précise.
Tous les êtres vivants pluricellulaires possèdent des cellules souches. Elles sont à l’origine de tous les tissus et en assurent le renouvellement (remplacement des cellules disparaissant par vieillissement ou par lésion). Les cellules souches sont à l’origine de la régénération des membres chez certains animaux (lézards, tritons, etc.).

Les cellules des plantes présentent une particularité : il est généralement facile de créer une plante entière à partir d’une cellule. Ce phénomène est à la base d’un mode de reproduction naturel des plantes : le bouturage. Il est utilisé massivement en arboriculture et pour les plantes d’ornement. Les cellules de plantes se comportent donc comme des cellules souches totipotentes.
([12] pp. 1-3, [13])
Toutes les cellules souches sont-elles équivalentes ?
Non. On distingue quatre catégories de cellules souches en fonction de la diversité des types cellulaires auxquels elles peuvent donner naissance :
• Les cellules souches unipotentes ne produisent qu’une seule sorte de cellules différenciées (exemple : cellules souches utilisées pour les greffes de peau).
• Les cellules souches multipotentes ne produisent qu’un nombre restreint de types cellulaires (exemple : les cellules souches de la moelle osseuse donnent naissance aux globules rouges, aux différentes sortes de globules blancs et aux plaquettes).
• Les cellules souches pluripotentes peuvent donner pratiquement tous les types cellulaires.
• Les cellules souches totipotentes peuvent donner naissance à un individu complet car elles sont, comme l’oeuf, capables de participer à la formation de tous les tissus d’un individu adulte ainsi qu’à celle du placenta. ([13])
Qu’est-ce qu’une cellule souche adulte ou multipotente ?
C’est une cellule souche capable de donner naissance à un ou plusieurs groupes de cellules ayant une fonction particulière. Par exemple, les cellules souches présentes dans la moelle osseuse produisent les globules rouges, les globules blancs et les plaquettes.
Les cellules souches multipotentes jouent un rôle essentiel en assurant le renouvellement des cellules. Elles sont appelées aussi cellules souches adultes ou cellules souches somatiques.
([12] p. 2, [13])
Où sont les cellules souches adultes (multipotentes) ?
Des cellules souches adultes ont pu être extraites de la plupart des tissus, y compris du cerveau et de la moelle épinière. Cependant, elles sont rares (une cellule souche pour dix ou quinze milles autres cellules dans la moelle osseuse) et difficiles à identifier. La culture des cellules souches au laboratoire est encore loin d’être maîtrisée.
La moelle osseuse et le sang du cordon ombilical sont particulièrement riches en cellules souches adultes. Les cellules souches du sang de cordon ombilical peuvent être prélevées à la naissance et conservées pour un usage ultérieur. Elles sont utilisées à des fins de recherche ou pour soigner par thérapie cellulaire le donneur ou ses frères et soeurs. Il existe une centaine de banques de sang de cordon ombilical, principalement en Europe et en Amérique du Nord, qui se chargent de leur conservation. Les trois quarts de ces banques sont des institutions sans but lucratif.
([21] p. 23, pp. 37-38, [40] pp. 9-10)
 Cellules souches de moelle osseuse
Cellules souches de moelle osseuse
Qu’est-ce qu’une cellule souche embryonnaire ou pluripotente ?
Dans l’embryon de cinq à sept jours, il existe un amas de cellules (masse cellulaire interne) capables de produire pratiquement tous les tissus sauf le placenta. Elles ne peuvent donc plus produire un embryon viable. On dit que ces cellules sont pluripotentes. Ces cellules sont aussi appelées cellules souches embryonnaires.
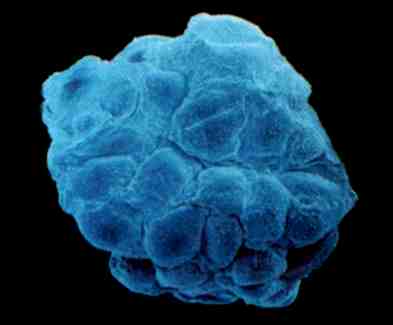 Blastocyte (embryon de moins de 7 jours) qui contient à l'intérieur la masse cellulaire interne.
Blastocyte (embryon de moins de 7 jours) qui contient à l'intérieur la masse cellulaire interne.
Il existe encore des cellules souches pluripotentes chez l’embryon âgé de cinq à dix semaines. Elles sont situées dans la zone qui donnera plus tard les testicules ou les ovaires. Elles sont appelées cellules germinales embryonnaires ou cellules germinales primordiales.
([21] p. 11)
Où sont les cellules souches embryonnaires (pluripotentes) ?
La principale source de cellules souches embryonnaires est l’embryon de cinq à sept jours. Chez l’homme, les cellules souches sont extraites des embryons surnuméraires (non implantés dans un utérus et conservés par congélation) produits à l’occasion d’une fécondation in vitro (FIV).
Des cellules souches embryonnaires peuvent aussi être extraites des embryons issus d’une interruption volontaire de grossesse. Ce sont des cellules germinales primordiales. Elles ont approximativement les mêmes propriétés que les cellules souches extraites de l’embryon de cinq à sept jours.
([4], [16], [21] pp. 18-19)
Qu’est-ce qu’une cellule souche totipotente ?
L’oeuf fécondé, et très vraisemblablement chacune des huit premières cellules qui en dérivent, peuvent chacun donner naissance à un être complet. On dit que ces cellules sont totipotentes. Elles peuvent être observées au laboratoire à l’occasion d’une fécondation in vitro (FIV).
([13])
Peut-on déclencher sur commande la production d’un type cellulaire donné ?
Le mécanisme de différenciation des cellules à partir d’une cellule souche est encore mal compris. Le phénomène de différenciation est dépendant de substances biologiques qui sont loin d’être toutes identifiées. Les techniques d’études sont encore empiriques et les chercheurs explorent de nombreuses pistes pour comprendre le déclenchement et le déroulement du processus de différenciation. Pour « inciter » les cellules souches à se différencier on peut les introduire chez l’animal au niveau d’un tissu lésé : par exemple, on peut injecter des cellules souches dans un coeur ayant subi un infarctus pour que les cellules souches se transforment en cellules cardiaques. On peut aussi cultiver les cellules souches en présence de cellules plus différenciées.
([21] Appendix C 5-6, [45])
Les cellules souches prélevées chez un adulte peuvent-elles produire tous les types cellulaires ?
Les cellules souches présentes dans la moelle osseuse peuvent, dans certaines conditions expérimentales, produire des cellules autres que les cellules du sang (cellules du muscle et des os, cellules nerveuses, etc.) et même générer des structures complexes comme des vaisseaux sanguins (constitués de plusieurs types cellulaires). De même, des cellules souches extraites du cerveau peuvent produire, outre les cellules nerveuses, les cellules du muscle.
Des observations similaires ont été faites avec des cellules extraites de la plupart des tissus. Cependant il est difficile de savoir si les extraits ne contiennent pas, en fait, un mélange de cellules souches ayant des spécificités différentes.
([21] Executive summary 6-7, Appendix D.V., [28])
Est-on obligé de créer des embryons pour étudier les cellules souches embryonnaires (pluripotentes) ?
Les cellules souches embryonnaires n’existent que chez l’embryon. Cependant, de nombreuses recherches sont possibles sans fabriquer de nouveaux embryons pour étudier ces cellules. D’une part, les scientifiques disposent déjà de plusieurs dizaines de lignées de cellules souches embryonnaires. D’autre part, il existe de nombreux (plusieurs dizaines de milliers en France) embryons congelés créés dans le cadre de l’assistance médicale à la procréation et que les parents ne souhaitent plus utiliser pour donner naissance à des enfants.
([24], [25])
Peut-on transformer une cellule différenciée en cellule souche totipotente ?
Oui, en théorie, puisque toutes les cellules d’un individu contiennent la même information génétique. Cependant, pour qu’une cellule différenciée retourne à un état qui lui permette d’utiliser son information génétique de la même façon qu’une cellule souche totipotente, un artifice technique est nécessaire.
Cet artifice (que l’on désigne souvent désormais par le terme de clonage) consiste à fusionner une cellule différenciée et un ovule (cellule reproductrice femelle non fécondée) privé de son noyau (donc de la majeure partie de son information génétique). L’information génétique de la cellule différenciée se retrouve ainsi dans un environnement très particulier, qui permet qu’elle soit exprimée comme dans un oeuf fécondé. La cellule ainsi recomposée est donc totipotente : elle est capable de se diviser pour donner un embryon qui peut devenir un animal s’il est transféré dans l’utérus d’une mère porteuse de la même espèce. C’est ainsi qu’ont été obtenues la brebis Dolly et la vache Marguerite.
([14], [18])
La transformation des cellules différenciées en cellules totipotentes est-elle une technique maîtrisée ?
Non, il est très difficile d’obtenir des cellules totipotentes pleinement fonctionnelles (c’est-à-dire capable de donner naissance à un individu en bonne santé) à partir de cellules différenciées. En avril 2006, les scientifiques avaient réussi cette transformation chez une dizaine d’espèces de mammifères (brebis, chat, cochon, lapin, souris, veau, etc.), mais pas chez l’homme.
L’implantation dans l’utérus d’un animal de la même espèce, d’embryons issus de ces cellules différenciées « transformées » en cellules totipotentes aboutit exceptionnellement à la naissance d’un animal en bonne santé. Le nombre de naissance d’animaux vivants par rapport au nombre d’embryons créés reste inférieur à 5 % dans le meilleur des cas (434 tentatives ont été nécessaires avant de donner naissance à Dolly). C’est un taux de réussite cinq fois plus faible qu’avec la fécondation in vitro (FIV).
([12] pp. 17-20, [14], [36], [38], [53])
Nos cellules sont-elles toutes pareilles ou toutes différentes ?
Toutes les cellules d’un organisme sont issues d’une unique cellule (l’oeuf, produit de la fécondation de l’ovule par le spermatozoïde) et ont la même information génétique (génome) qu’elle. A partir de cette information, chaque cellule sait fabriquer les protéines qui lui donnent sa morphologie, ses capacités fonctionnelles.
Nos cellules sont donc toutes semblables, car elles contiennent la même information génétique.
Mais elles sont aussi différentes, car leur fonction et leur morphologie sont différentes. Ces différences s’expliquent par le fait qu’une partie seulement de l’information génétique commune est utilisée par chaque cellule à un moment donné. Pour chaque type cellulaire, la fraction de l’information exprimée dépend de paramètres variés (par exemple, la position de la cellule dans le corps).
([8], [15])
Y-a-t il des similitudes entre cellules souches et cellules cancéreuses ?
Les cellules souches comme les cellules cancéreuses ont la capacité de se multiplier indéfiniment, elles sont dites immortelles. Mais la prolifération des cellules souches reste sous le contrôle des cellules environnantes et du reste de l’organisme, alors que celle des cellules cancéreuses échappe à ce contrôle. En outre, les cellules cancéreuses ont la faculté d’envahir d’autres tissus.
([8])
 Une colonie de cellules cancéreuses du sein. Les cellules bleues sont en pleine croissance, tandis que les cellules jaunes sont en train de mourrir. Annie Cavanagh, Wellcome Images.
Une colonie de cellules cancéreuses du sein. Les cellules bleues sont en pleine croissance, tandis que les cellules jaunes sont en train de mourrir. Annie Cavanagh, Wellcome Images.
Peut-on contrôler la prolifération des cellules ?
Un facteur clé du contrôle de la prolifération cellulaire est une enzyme (la télomérase) présente dans toutes les cellules en très faible quantité. Cette enzyme est assez inhabituelle puisqu'elle est composée d'une partie protéique et d'une partie nucléique (RNA).
 Wikipedia
Wikipedia
Un léger excès de cette enzyme permet aux cellules de se multiplier indéfiniment alors qu’un léger déficit provoque leur mort après quelques dizaines de divisions.
Depuis le début des années 1990, les scientifiques tentent de contrôler la quantité de télomérase dans les cellules afin d’empêcher la prolifération des cellules cancéreuses. Cet objectif n’est pas atteint aujourd’hui([2]) On peut souligner qu'en 2009, le prix nobel de médecine et de physiologie vient d'être attribué à Elizabeth Blackburn, Carol Greider et Jack Szostak pour leur travaux sur les télomères et la télomérase, éclairant du même coup les phénomènes du vieillissement ou de l'apparition d'un cancer,
Est-il facile de préparer et de cultiver des cellules souches embryonnaires ?
Les scientifiques savent préparer et cultiver des cellules souches embryonnaires de souris depuis le début des années 1980. L’adaptation de cette technique à d’autres espèces s’est avérée très difficile. Elle a été réussie par une équipe de cancérologues. La culture de cellules souches embryonnaires de singe est possible depuis 1996 et celle de cellules humaines depuis 1998.
([2], [4], [16], [17])
Pourquoi faire des recherches sur les cellules souches des singes ?
La souris est l’animal le plus couramment utilisé au laboratoire pour étudier les maladies humaines et leur traitement. Cependant les résultats obtenus chez la souris ne sont pas tous directement généralisables à l’homme. Les recherches sur le macaque et le ouistiti apportent des informations complémentaires : par exemple, l’étude du fonctionnement du cerveau humain ne peut, par essence, pas être approché par les études menées chez la souris alors que les expériences réalisées chez le singe, espèce plus proche de l’homme, apportent des informations essentielles. Les hypothèses formées à partir de l’étude des singes doivent être testées chez l’homme.
L’expérimentation humaine est indispensable pour évaluer l’utilité thérapeutique réelle d’une méthode mise au point chez l’animal.
([4])
Clone et clonage : de quoi s’agit-il ?
Un clone est un ensemble d’entités génétiquement identiques. Il peut s’agir de cellules ou d’êtres vivants complexes. Depuis la naissance de la brebis Dolly, on applique aussi le terme de clone à un animal obtenu au laboratoire par le transfert d’un noyau dans un ovule privé de son propre noyau.
Le terme de clonage s’applique à différentes techniques visant à obtenir un clone.
([31])
Les vrais jumeaux sont-ils des clones ?
Un clone est un être vivant possédant la même information génétique que l’individu dont il est issu. Les vrais jumeaux sont donc des clones de l’embryon qui leur a donné naissance, en se scindant naturellement dans les premiers jours de son développement.
Il est possible de produire artificiellement des jumeaux en scindant un embryon produit par fécondation in vitro. Cette opération est réalisée couramment dans les centres de recherche pour les animaux d’élevage, mais elle est interdite chez l’homme.
([12] p. 14)
Qu’est-ce que le clonage reproductif ?
Le clonage reproductif désigne le procédé visant à obtenir des animaux sans passer par la reproduction sexuée. Le procédé utilise le transfert d’un noyau dans un ovule privé de son propre noyau.
Initialement, la technique consistait à fusionner une cellule embryonnaire prélevée dans un embryon de trois ou quatre jours et un gamète femelle non fécondé (appelé ovocyte ou ovule) privé de son noyau. La cellule recomposée résultant de cette fusion est totipotente et produit un embryon. Celui-ci est ensuite transféré dans l’utérus d’une mère porteuse de la même espèce et la grossesse suit un cours normal. La technique est utilisée depuis le milieu des années 1980 pour les animaux d’élevage, 6 à 10 % des embryons reconstitués aboutissant à une naissance. La technique a été étendue aux singes en 1997.
Une technique plus récente permet de cloner un animal adulte en partant d’une cellule différenciée prélevée chez l’individu à cloner, à la place d’une cellule embryonnaire. La technique n’est au point que chez une dizaine d’espèces de mammifères (la brebis Dolly par exemple) et le taux de succès est très bas (moins de 5 % de naissances dans le meilleur des cas).
([12] p. 14, [14], [18], [53])

Depuis quand le clonage reproductif est-il étudié ?
Les premiers essais de clonage reproductif chez les animaux remontent à la fin des années 1930. Les premiers succès ont été obtenus chez la grenouille dans les années 1950. La mise au point du clonage reproductif chez les mammifères s’est avérée très difficile sans que l’on sache pourquoi. Le premier mammifère cloné est Dolly, en 1997.
La mise au point des techniques de clonage reproductif permet l’étude des mécanismes de différenciation cellulaire. Les scientifiques pensent que ces recherches peuvent aussi aider à comprendre les mécanismes de formation des cancers.
Plus récemment, les scientifiques ont vu dans le clonage reproductif un moyen de multiplier des animaux ayant des caractéristiques exceptionnelles ou de sauvegarder des espèces en voie de disparition.
([12] pp. 20-27, [18])
Le clonage reproductif permettra-t-il de ressusciter des espèces disparues ?
La possibilité de cloner un animal empaillé a été évoquée dès l’annonce de la création de la brebis Dolly. Ceci est pour l’instant de la pure science fiction. Il faut tout d’abord étendre la technique à d’autres espèces. Mais il faut surtout disposer d’une mère porteuse de la même espèce ou d’une espèce très proche. Et, enfin, il faut cloner des individus des deux sexes !
([3])
Clonage reproductif, animaux génétiquement modifiés : quel lien ?
Le clonage reproductif est une technique très lourde. Son emploi se justifie pour la « création » d’animaux qui ne peuvent plus être produits par reproduction sexuée (dernier représentant d’une espèce), et surtout pour la fabrication des animaux génétiquement modifiés (appelés aussi transgéniques) qu’elle simplifie beaucoup. La procédure comporte deux temps. Un gène étranger (ou transgène) est introduit dans des cellules en culture, puis les cellules transformées (ayant incorporé le transgène) sont utilisées pour la fabrication d’un clone par transfert de noyau.
Cette méthode produit des animaux dont toutes les cellules (y compris les cellules reproductrices) sont génétiquement modifiées. Leur descendance, obtenue par une reproduction sexuée normale, possède de ce fait le même transgène que celui inséré dans le génome de ses parents.
([14], [18])
A quoi les animaux génétiquement modifiés sont-ils utiles ?
Il existe actuellement trois grands types d’usage :
• La recherche médicale : production d’animaux transgéniques pouvant servir de modèle pour la recherche sur les maladies humaines,
• La production de molécules à usage thérapeutique,
• La production d’organes humanisés par des animaux (surtout le porc) dotés artificiellement d’un système immunitaire similaire à celui de l’homme afin de pouvoir les transplanter chez l’homme sans risque de rejet. Ces applications n’en sont qu’aux premiers stades du processus qui aboutira, peut-être, à une production industrielle.
([12] pp. 21-26)
Quelles sont les différentes façons d’obtenir des clones ?
Il est possible d’obtenir des clones grâce aux techniques de clonage par transfert de noyau (décrites à propos du clonage reproductif animal) mais aussi à partir d’une seule cellule (un gamète femelle non fécondé) : c’est la parthénogenèse. Les scientifiques savent déclencher artificiellement un développement parthénogénétique chez certains mammifères. L’embryon a le même génome que sa mère. En général, l’embryon ne se développe pas au-delà de quelques jours. Le premier mammifère parthénogénétique viable a été obtenu en 2004 (c’est une souris).
Ces travaux avaient pour but de comprendre le déclenchement du développement embryonnaire. Certains y voient maintenant, en plus, une source de cellules souches embryonnaires.
([15], [34], [41])
Les animaux obtenus par clonage sont-ils en bonne santé ?
La production d’animaux par clonage n’est pas une technique maîtrisée : elle se heurte à un taux très élevé d’avortement (moins de 5 % des embryons implantés se développent jusqu’à donner naissance à un animal) et à une forte mortalité juvénile (40 % des veaux issus de clonage meurent avant un an). En revanche, les animaux qui atteignent l’âge adulte semblent normaux. Ils se reproduisent sans problème et leur descendance est tout à fait normale.
([53])
Qu’appelle-t-on la thérapie cellulaire ?
La thérapie cellulaire consiste à utiliser des cellules souches pour remplacer des tissus lésés. En effet, de nombreuses maladies résultent de la destruction d’un tissu ou d’un mauvais fonctionnement de certaines cellules. Les transplantations d’organes ou les greffes de tissu ne permettent de traiter que certains cas et la thérapie cellulaire pourrait couvrir d’autres domaines thérapeutiques.
Le développement récent des connaissances sur les cellules souches pourrait déboucher dans plusieurs années sur un élargissement des possibilités de la thérapie cellulaire, encore limitées aujourd’hui.
([13])
Quelles sont les thérapies cellulaires utilisées actuellement en médecine ?
Le plus ancien traitement utilisant des cellules souches est la transplantation de moelle osseuse. Il est utilisé de façon routinière depuis les années 1970 pour les maladies du sang et du système immunitaire. L’autre traitement existant est la greffe de peau, pour les grands brûlés par exemple. Dans les deux cas, le traitement exploite la présence de cellules souches adultes dans le tissu utilisé pour la greffe.
([12] pp. 32-34, [21] p. 43)
Comment se pratique une greffe des cellules souches du sang ?
La technique la plus utilisée reste la greffe de moelle osseuse, mais les médecins ont de plus en plus souvent recours à des cellules souches extraites du sang d’un adulte ou, depuis une dizaine d’années, du sang de cordon ombilical. Pour pouvoir extraire en quantité suffisante les cellules souches présentes dans le sang, il faut au préalable administrer au donneur un produit qui stimule leur multiplication. La réussite de la greffe nécessite l’administration au receveur de médicaments immunodépresseurs (qui diminuent la réponse du système immunitaire, donc le risque de rejet de la greffe). Un inconvénient notable de ces médicaments est de rendre le receveur très sensible aux agents infectieux.
([6] pp. 35-36, [12] pp. 32-33)
Existe-t-il des contraintes biologiques limitant le recours à la thérapie cellulaire ?
Pour réussir, la thérapie cellulaire nécessite que le donneur et le receveur aient des génomes les plus semblables possibles. Il faut au minimum que le donneur et le receveur aient les mêmes groupes tissulaires (qui jouent, pour les greffes, le même rôle que les groupes sanguins dans les transfusions). Il y a une chance sur quatre pour que deux frères aient les mêmes groupes tissulaires. Mais, même ainsi, une greffe de cellules souches du sang entre frères déclenche une réaction de rejet dans 30 à 40 % des cas et elle est mortelle dans 10 % des cas. En revanche, les cellules prélevées dans le sang du cordon ombilical déclenchent rarement un rejet de greffe violent.
Certains traitements permettent de diminuer les défenses immunitaires du receveur. Ceci facilite les greffes mais, en contre-partie, la personne traitée devient très sensible à toutes les infections. Les seules greffes ne posant pas problème de rejet sont celles où sont administrées au receveur ses propres cellules souches, par exemple pour les greffes de peau ou certaines greffes de moelle osseuse (dans le cadre d’un traitement anticancéreux drastique : la moelle – non touchée par la maladie – est prélevée avant le traitement, conservée par congélation, puis réinjectée).
([12] p. 33)
Quel rapport entre thérapie génique, manipulation génétique, OGM et clonage ?
La manipulation génétique est une technique permettant de supprimer un ou plusieurs gènes d’un génome ou, à l’inverse, d’insérer un ou des gènes étrangers dans un génome. L’OGM (organisme génétiquement modifié) est le résultat de ces manipulations génétiques. La thérapie génique est l’utilisation des manipulations génétiques de cellules humaines dans le but de traiter une maladie.
La thérapie génique devrait remplacer à terme les simples greffes de moelle dans le cas des maladies génétiques du sang. Le premier essai clinique a été réalisé entre mars 1999 et mai 2002. Les premiers résultats sont encourageants (l’état général est bon pour six des dix enfants traités). Mais la technique n’est pas encore maîtrisée : trois enfants ont eu une leucémie et le traitement a été inefficace chez un quatrième.
([21] p. 99, [48])
Qu’est-ce que le clonage thérapeutique ?
Le clonage thérapeutique a pour objet la production de cellules souches embryonnaires ayant le même génome que l’individu cloné. Son intérêt majeur serait de permettre une thérapie cellulaire ultérieure sans risquer un rejet de greffe.
Pour atteindre cet objectif (identité des génomes évitant le rejet de greffe), l’embryon à partir duquel seront obtenues les cellules souches ne peut être créé qu’à partir d’une cellule différenciée prélevée chez l’individu à qui est destinée la greffe. Celle-ci est fusionnée avec une cellule reproductrice femelle non fécondée privée de son noyau. Au bout de cinq à sept jours, on extrait de l’embryon des cellules souches embryonnaires ayant exactement le même génome que l’individu qui a donné la cellule différenciée.
Dans les pays où cette technique est autorisée, l’embryon humain doit être détruit au plus tard au quatorzième jour. Il n’est jamais transféré dans une mère porteuse.
([14])
Quels sont les obstacles techniques à l’utilisation des cellules souches en médecine ?
On ne sait pas aujourd’hui réaliser cette opération sur les animaux. Sauf pour ce qui concerne les greffes de moelle osseuse et de peau, de nombreuses années de recherche sont encore nécessaires avant que les solutions soient au point chez l’homme.
Il existe deux obstacles majeurs :
• Les cellules souches ne sont pas utiles en tant que telles, quelle que soit leur origine. Elles servent à produire de grandes quantités de cellules dont le type correspond au tissu à restaurer. Orienter la différenciation des cellules souches et contrôler leur multiplication une fois qu’elles sont administrées à un patient sont des opérations très difficiles, non maîtrisées actuellement.
• Les cellules injectées, sauf cas exceptionnels, sont très rapidement éliminées : elles sont rejetées par le système immunitaire du receveur. La seule façon naturelle d’éviter ce rejet est de prélever les cellules souches chez le receveur et de les multiplier avant de les lui réinjecter. ([21] Executive summary 5)
Quels résultats produit l’utilisation des cellules souches chez les animaux ?
Les essais ont eu lieu jusqu’ici chez la souris. La majorité d’entre eux porte sur les maladies auto-immunes (arthrite, diabète, etc.), la dégénérescence du système nerveux et la réparation du coeur après un infarctus. Dans tous les cas, les chercheurs ont obtenu des résultats prometteurs, mais dans des conditions de laboratoire très particulières qui ne sont pas directement applicables à l’homme.
Par exemple, l’injection de cellules souches dans le coeur immédiatement après un infarctus permet une restauration du muscle cardiaque chez la souris. Mais un traitement équivalent chez l’homme, en imaginant que tous les autres problèmes soient résolus, nécessiterait d’injecter des millions de cellules préparées au préalable à partir des cellules souches du patient. Ce n’est pas compatible avec la brutalité d’un infarctus et l’urgence du traitement.
([21] p. 91)
Quels sont les risques pour la santé de greffe de cellules souches ?
Les principaux risques envisageables sont :
• Rejet des cellules greffées. Comme pour toute greffe, les cellules souches peuvent être rejetées par le système immunitaire du receveur. La façon la plus efficace d’éviter ce rejet est d’utiliser les cellules souches du patient : multiplication de ses propres cellules souches adultes ou clonage thérapeutique. Juin 2006 15/26 Cellules souches et clonage : l’humain, un cas à part ? ©Science & Décision Mais, en dehors du cas des greffes de peau et de moelle osseuse, aucune de ces techniques n’est opérationnelle actuellement.
• Déclenchement d’un cancer. Les fortes similitudes entre cellules souches et cellules cancéreuses font craindre que les cellules souches puissent déclencher un cancer chez le receveur si leur multiplication n’est pas strictement contrôlée. Ceci est envisageable car les cellules souches placées dans un environnement tissulaire qui n’est pas le leur peuvent rester indifférenciées et former une tumeur.
• Transmission d’agents infectieux. Comme pour toutes les greffes et les transfusions, il faut s’assurer que le donneur n’est pas porteur d’agents infectieux. ([12] pp. 62-63, [21] p. 54, p. 94, Appendix A-15)
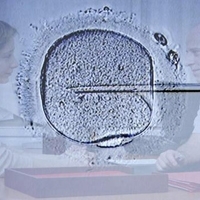
Qu’est-ce que l’assistance médicale à la procréation ?
Un couple sur six est atteint d’infertilité (difficulté ou incapacité à concevoir un enfant). L’assistance médicale à la procréation a pour but d’y remédier. Plusieurs techniques sont utilisées :
• L’insémination artificielle consiste à introduire le sperme d’un donneur dans les voies génitales de la femme. Elle est utilisée en cas d’infertilité d’origine masculine (à condition que le sperme contienne au moins cinq millions de spermatozoïdes par millilitre). On distingue l’insémination artificielle conjugale et l’insémination artificielle avec donneur. L’insémination artificielle est à l’origine de 0,5 % des naissances en France.
• La fécondation in vitro consiste, après avoir stimulé par des hormones la production d’ovules, à reproduire en laboratoire les premières étapes des processus de fécondation et de développement embryonnaire. Elle ne peut être réalisée que dans des centres agréés par le ministère de la santé. En France, 30 000 couples environ ont recours chaque année à la fécondation in vitro et 1,3 % des naissances en sont issues. Ce taux dépasse 2 % dans les pays scandinaves.
• La stimulation de l’ovulation par un traitement hormonal est utilisée pour faciliter une procréation « naturelle », sans autre intervention médicale. Elle ne fait pas l’objet d’un suivi précis car elle n’entre pas actuellement dans un cadre réglementaire spécifique. Elle concerne de 50 000 à 100 000 femmes par an en France. ([5], [6] p. 88, [20], [32])
Quelles sont les grandes étapes d’une fécondation in vitro ?
La première étape consiste à stimuler, par l’administration de traitements hormonaux à la femme, la production et la maturation d’ovules prêts à être fécondés, qui sont alors prélevés par ponction.
Après avoir été prélevé chez la mère, l’ovule est fécondé au laboratoire, avec les spermatozoïdes du père. Deux techniques de fécondation peuvent être utilisées (fécondation conventionnelle ou micro-injection du spermatozoïde). En moyenne, les trois quarts seulement des ovules fécondés se développent pour devenir des embryons de quatre cellules, que l’on peut implanter dans l’utérus de la mère deux jours après la ponction des ovules. Un tiers des implantations échoue. C’est pourquoi, en France, les médecins tentent la fécondation de tous les ovules obtenus.
L’implantation d’un embryon produit au laboratoire ne conduit pas toujours au développement d’une grossesse. Pour cette raison, les médecins transfèrent plusieurs embryons à chaque tentative. Afin d’éviter les grossesses multiples, on conseille aujourd’hui de ne pas transférer plus de deux embryons, tout en congelant les autres.
L’ensemble des opérations mène à la naissance d’au moins un enfant dans un peu plus d’un cas sur cinq. C’est un taux de succès voisin de celui de la fécondation naturelle.
([32])
Quels sont les risques pour la santé de l’assistance médicale à la procréation ?
Les risques sont liés au traitement hormonal et aux grossesses multiples :
• Le traitement hormonal peut provoquer des troubles liés à l’hyperstimulation des ovaires. Ils peuvent aller jusqu’à mettre en danger la vie de la mère (kystes ovariens, diminution importante du volume de sang, etc.).
• Le traitement hormonal est aussi très souvent à l’origine de grossesses multiples auxquelles sont associées, surtout dans le cas des triplés, de problèmes médicaux graves (grande prématurité plus fréquente) et des difficultés familiales. Ceci peut conduire les médecins à éliminer en cours de grossesse un ou plusieurs embryons sans interrompre le développement des autres. Cette intervention nécessite au préalable l’accord écrit de la mère. ([1], [6] pp. 87-88).

Qu’appelle-t-on embryon « surnuméraire » et embryon « orphelin » ?
La fécondation in vitro aboutit à une naissance dans un peu plus d’un cas du cinq. C’est pourquoi les médecins multiplient les fécondations et congèlent une partie des embryons ainsi produits. Ces embryons pourront être ainsi utilisés, si nécessaire, pour une seconde tentative de transfert. Les embryons congelés dans cette perspective (environ 30 000 embryons chaque année en France) sont appelés « surnuméraires ».
Une partie de ces embryons « surnuméraires » ne seront jamais transférés dans un utérus maternel (par exemple parce que la première tentative d’implantation aura mené à une naissance) : ces embryons sont dits « orphelins ».
([11])
Qui est responsable des embryons « surnuméraires » ?
La loi du 6 août 2004 relative à la bioéthique prévoit que les parents seront consultés tous les ans sur leur souhait concernant le sort des embryons congelés « surnuméraires ». Plusieurs cas sont possibles :
• conservation des embryons en vue d’une grossesse ultérieure,
• don à un autre couple en vue d’une grossesse,
• don à la recherche. Après cinq ans de conservation, l’embryon est détruit si les parents n’ont pas répondu après plusieurs relances ou lorsqu’ils ne sont pas d’accord sur le devenir de l’embryon.
([7] pp. 21-22, [43] Art. L. 2141-4)
Quelle est la recherche autour de l’assistance médicale à la procréation ?
Il y a peu de recherche en dehors de celle relative au contrôle hormonal de la stimulation ovarienne et de la mise au point de kits de diagnostic pré-implantatoire (c’est-à-dire avant le transfert des embryons dans l’utérus maternel) pour l’identification de maladies génétiques.
Les scientifiques ont élaboré des hormones synthétiques qui visent à se rapprocher de la physiologie normale, puis des hormones issues du génie génétique qui reproduisent l’hormone naturelle.
([7] pp. 21-22, pp. 267-268, [35])
Est-il possible de fabriquer un être humain dans une éprouvette ?
Non, l’essentiel du développement nécessite des interactions mère – enfant complexes qui se déroulent à travers le placenta, dans l’utérus maternel.
Cependant, il est possible d’une part de mener à bien au laboratoire les premiers jours du développement et d’autre part de sauver parfois un grand prématuré à partir de la vingtième semaine. Pour l’instant, les médecins savent donc suppléer à la nature pour ce qui concerne la fécondation, le début et le fin du développement utérin d’un embryon.
([33])

Les recherches sur les embryons et les cellules embryonnaires des animaux sont-elles autorisées ?
La recherche fondamentale est autorisée sur les embryons et les cellules souches des animaux. Le clonage reproductif par transfert de noyau, l’extraction et la culture de cellules souches embryonnaires ont été mis au point sur des animaux (animaux d’élevage, souris et singes).
Les recherches sur l’embryon et les cellules embryonnaires humains sont-elles autorisées en France ?
La loi du 6 août 2004 relative à la bioéthique interdit la recherche sur l’embryon humain. Cependant, par dérogation, les recherches peuvent être autorisées sur l’embryon et les cellules embryonnaires humains lorsqu’elles sont susceptibles de permettre des progrès thérapeutiques majeurs et à la condition de ne pouvoir être poursuivies par une méthode alternative d’efficacité comparable, en l’état des connaissances scientifiques. La recherche ne peut être conduite que sur des embryons surnuméraires conçus dans le cadre d’une fécondation in vitro et avec le consentement écrit des deux parents.
Une recherche ne peut être entreprise que si son protocole a fait l’objet d’une autorisation par l’Agence de la biomédecine. La décision d’autorisation est prise en fonction de la pertinence scientifique du projet de recherche, de ses conditions de mise en oeuvre au regard des principes éthiques et de son intérêt pour la santé publique.
La décision finale d’autorisation appartient aux ministres chargés de la santé et de la recherche. Ils peuvent interdire ou suspendre une recherche ayant obtenu l’accord de l’Agence lorsque sa pertinence scientifique n’est pas établie ou lorsque le respect des principes éthiques n’est pas assuré. A l’inverse, lorsque l’Agence refuse un protocole de recherche, les mêmes ministres peuvent lui demander de réexaminer le dossier dans l’intérêt de la santé publique ou de la recherche scientifique.
L’importation et l’exportation de cellules embryonnaires aux fins de recherche est soumise à l’autorisation préalable de l’Agence de la biomédecine.
La loi prévoit que le dispositif sera réexaminé début 2011, après une évaluation des résultats des recherches sur les cellules souches embryonnaires et sur les cellules souches adultes.
([43] Art. L. 2151-5, L. 2151-6, L. 2151-7, [55])
Les recherches sur les cellules embryonnaires humaines sont-elles autorisées en Europe ?
Il n’existe pas de législation au niveau de l’Union européenne sur les recherches sur les cellules embryonnaires humaines. Les législations diffèrent selon les Etats membres. Schématiquement, la situation était la suivante en février 2006 :
• Autriche, Lituanie, Pologne – interdiction de la recherche sur les cellules embryonnaires humaines.
• Allemagne, Italie – interdiction de produire des cellules embryonnaires humaines ; autorisation sous certaines conditions des recherches sur des cellules embryonnaires provenant d’autres pays.
• Danemark, Espagne, Finlande, France, Grèce, Hongrie, Pays-Bas, Slovénie – autorisation sous certaines conditions des recherches sur des cellules embryonnaires produites à partir des embryons surnuméraires résultant d’une fécondation in vitro ; interdiction de créer des embryons humains spécifiquement destinés à la production de cellules embryonnaires.
• Belgique, Royaume-Uni, Suède – autorisation de produire des cellules embryonnaires à partir des embryons surnuméraires résultant d’une fécondation in vitro ; autorisation de créer des embryons humains spécifiquement destinés à la production de cellules embryonnaires notamment par clonage par transfert de noyau (le clonage thérapeutique).
• Chypre, Estonie, Irlande, Lettonie, Luxembourg, Malte, Portugal, République tchèque, Slovaquie – débats en cours. ([42], [54])
Les recherches sur les cellules embryonnaires humaines sont-elles autorisées hors d’Europe ?
La recherche sur les cellules embryonnaires humaines est autorisée, selon des modalités variables, dans la plupart des pays scientifiquement développés. Schématiquement, la situation dans le monde était la suivante en mai 2006.
Aux Etats-Unis, les financements fédéraux ne peuvent être attribués qu’aux recherches portant sur une vingtaine de lignées de cellules embryonnaires humaines dont la liste a été établie le 9 août 2001. En dehors de cette restriction, il n’existe pas de loi fédérale sur les recherches sur les embryons et les cellules embryonnaires humains. L’encadrement législatif varie d’un Etat à l’autre. En Californie, la loi autorise la création d’embryons humains spécifiquement destinés à produire des cellules embryonnaires et le clonage par transfert de noyau (le clonage thérapeutique). En 2004, l’Etat de Californie a programmé un financement de 300 millions de dollars par an pendant 10 ans pour les recherches sur les cellules embryonnaires humaines, ce qui est sans commune mesure avec le financement fédéral correspondant pour l’ensemble des Etats-Unis (25 millions de dollars en 2003).
Les autres pays pouvaient être classés en deux grandes catégories :
• Ceux où la loi n’autorise que la recherche sur des cellules embryonnaires issues des embryons surnuméraires résultant d’une fécondation in vitro (Australie, Brésil, Canada, Russie, Taiwan notamment).
• Ceux où la loi autorise non seulement la recherche sur des cellules embryonnaires issues des embryons surnuméraires résultant d’une fécondation in vitro, mais aussi la création d’embryons humains spécifiquement destinés à produire des cellules embryonnaires et le clonage par transfert de noyau, appelé aussi clonage thérapeutique (Afrique du Sud, Chine, Corée du Sud, Inde, Iran, Israël, Japon, Singapour notamment). ([45], [58])
Peut-on dissocier la recherche sur le clonage thérapeutique de celle sur le clonage reproductif ?
Clonage thérapeutique et clonage reproductif reposent sur la même technique : le clonage par transfert de noyau. La différence porte uniquement sur l’usage qui est fait de l’embryon ainsi créé. Dans le cas du clonage thérapeutique, le fait de prélever des cellules souches détruit l’embryon. Dans le cas du clonage reproductif, l’embryon est transféré dans l’utérus d’une mère exactement comme pour une fécondation in vitro.
La dissociation des recherches sur le clonage thérapeutique et le clonage reproductif n’est pas du domaine de la science (absence de distinction au plan technique). L’interdiction du clonage reproductif est du registre de la morale ou de la loi. En mai 2006, le clonage reproductif était interdit dans tous les pays dotés d’une législation sur la recherche sur l’embryon humain.
([22], [58])
Les recherches sur l’embryon et les cellules souches peuvent-elles déboucher sur des brevets ?
Oui, les résultats de ces recherches ont donné lieu à des brevets aux Etats-Unis et dans d’autres pays. Les procédures mises au point pour produire de grandes quantités de cellules souches embryonnaires et pour le clonage par transfert de noyaux somatiques sont des solutions techniques à un problème technique sur lequel butaient les scientifiques depuis des décennies. Elles correspondent donc totalement à ce qu’on attend d’une invention brevetable.
L’Office européen des brevets a délivré pour la première fois un brevet sur les cellules embryonnaires humaines en février 2005. L’Office conserve cependant une politique très restrictive quant à la délivrance de brevets dans ce domaine. L’Europe en tant que telle n’a pas de position officielle.
([46], [50], [56])
Une invention peut-elle être brevetable dans un pays et non brevetable dans un autre ?
Les droits concédés par un brevet sont limités au pays où est accordé le brevet. Un brevet délivré par l’Office européen des brevets est potentiellement valable dans tous les pays ayant signé la Convention européenne des brevets et désignés par le demandeur. Cependant, un tribunal national peut toujours invalider un brevet à l’échelle d’un pays.
Au niveau international, l’harmonisation des conditions d’attribution des brevets n’est que partielle. Les différences d’interprétation des critères de brevetabilité sont particulièrement flagrantes pour les biotechnologies.
([19] p. 26, [30], [44], [52], [56])
Combien de brevets sur les cellules souches sont-ils déjà déposés ?
Il doit y avoir plus d’une dizaine de milliers de brevets sur les cellules souches dans le monde. Le nombre d’inventions est difficile à estimer car une même invention fait souvent l’objet de plusieurs brevets (un dépôt par pays où l’invention est protégée). Par ailleurs, beaucoup d’inventions sont encore confidentielles. Il existe en effet un délai, allant de 18 mois à plusieurs années selon les pays, entre le dépôt d’une demande de brevet et le moment où elle est rendue publique.
([29], [56], [57])
Les brevets sur les cellules souches embryonnaires humaines gênent-ils la recherche ?
Non. En effet, il existe une exemption pour la recherche. Cette exemption varie selon les pays mais de manière générale, on considère qu’il n’y a pas atteinte au droit des brevets lorsque l’invention brevetée est utilisée à des fins purement expérimentales. Aux Etats-Unis, la jurisprudence tend à limiter l’usage de l’exemption pour la recherche.
Le principal frein à la recherche fondamentale sur les cellules souches embryonnaires demeure les législations nationales sur la recherche sur l’embryon et les cellules embryonnaires humaines. Dans les pays où ces recherches sont autorisées, les scientifiques travaillent et publient librement leurs résultats. Les lignées de cellules souches embryonnaires nécessaires aux recherches peuvent être obtenues auprès des laboratoires qui en possèdent, à condition de s’engager à respecter certaines règles concernant les éventuelles applications commerciales découlant des résultats des recherches.
([25], [26], [27], [47] p. 6, [56])
Existe-t-il un marché pour la recherche sur les cellules souches ?
De nombreux experts estiment que le potentiel économique de ces nouvelles thérapies cellulaires est considérable. Selon eux, le marché économique des cellules souches représentait 24,6 milliards de dollars en 2005 et devrait presque tripler d’ici 2010.
Mais la plupart des scientifiques considèrent que de nombreux travaux de recherche fondamentale sont encore nécessaires avant de pouvoir se lancer avec quelques chances de succès dans une recherche à visée thérapeutique. De fait, à la fin de l’année 2005, les grands groupes pharmaceutiques ne s’étaient pratiquement pas engagés dans ce type de recherche. Et aucun essai thérapeutique utilisant des cellules souches embryonnaires n’était en cours.
La recherche privée sur les cellules souches reste l’apanage de quelques entreprises de biotechnologies spécialisées dans la régénération des tissus (peau, os, etc.). Elle porte principalement sur les cellules souches adultes et peut, dans ce cas, déboucher sur des traitements. Ainsi un nouveau médicament composé de cellules souches adultes a été lancé aux Etats-Unis fin 2005 pour soigner les malformations osseuses.
([39], [45], [49], [51], [56])

© Université
de TOURS - GÉNET
Document modifié le
20 mai, 2010